
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25 ℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项错误的是( )
①2CN-+H2O+CO2===2HCN+CO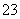
②2HCOOH+CO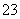 ===2HCOO-+H2O+CO2↑
===2HCOO-+H2O+CO2↑
③中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
④等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
A.①② B.②③
C.③④ D.①④
选D 根据电离平衡常数,HCN的电离程度介于H2CO3的一级电离和二级电离之间,因此①中反应错误,应为CN-+H2O+CO2===HCN+HCO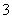 。HCOOH的电离程度大于H2CO3的一级电离,②正确。等pH的HCOOH和HCN,HCN溶液的浓度大,中和等体积、等pH的HCOOH和HCN,后者消耗NaOH的量大,③正确。在HCOONa和NaCN中存在电荷守恒:c(Na+)+c(H+)=c(HCOO-)+c(OH-),c(Na+)+c(H+)=c(CN-)+c(OH-)。等浓度的HCOONa和NaCN溶液,NaCN水解程度大,溶液中OH―浓度大,H+浓度小。根据电荷守恒,两溶液中离子总浓度为2,而Na+浓度相同,H+浓度后者小,因此等体积、等浓度的两溶液中离子总数前者大于后者,④错误。
。HCOOH的电离程度大于H2CO3的一级电离,②正确。等pH的HCOOH和HCN,HCN溶液的浓度大,中和等体积、等pH的HCOOH和HCN,后者消耗NaOH的量大,③正确。在HCOONa和NaCN中存在电荷守恒:c(Na+)+c(H+)=c(HCOO-)+c(OH-),c(Na+)+c(H+)=c(CN-)+c(OH-)。等浓度的HCOONa和NaCN溶液,NaCN水解程度大,溶液中OH―浓度大,H+浓度小。根据电荷守恒,两溶液中离子总浓度为2,而Na+浓度相同,H+浓度后者小,因此等体积、等浓度的两溶液中离子总数前者大于后者,④错误。


科目:高中化学 来源: 题型:
下列说法正确的是
A.用氨水洗涤附着银镜的试管 B.用CCl4作萃取剂直接从海带中提取I2
C.用向下排空气法收集NH3,并用湿润的蓝色石蕊试纸验满
D.制乙炔时滴加饱和食盐水是为了减缓电石与水的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
已知苯酚能跟碳酸钠溶液反应生成苯酚钠。现有如下转化:




 COOH COONa COONa COONa
COOH COONa COONa COONa




 HO—
HO—




CH2OH CH2OH CH2OH CH2ONa
根据上述转化关系回答下列问题:
(1)a.羧基 b.酚羟基 c.醇羟基提供质子的能力是(填编号)_____________________。
(2)①~⑤编号所用的试剂分别是:①_____________;②_____________;
③_______________;④________________ ;⑤________________。
(3)写出苯酚与碳酸钠溶液反应的离子方程式
_________________________________________________。
(4)写出乙醇钠与水反应的化学方程式
________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应aM(g)+bN(g)cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是( )
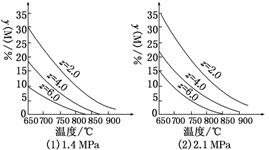
A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加
B.同压同z时,升高温度,平衡时Q的体积分数增加
C.同温同z时,增加压强,平衡时Q的体积分数增加
D.同温同压时,增加z,平衡时Q的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2+3H22NH3是工业上合成氨的重要反应。
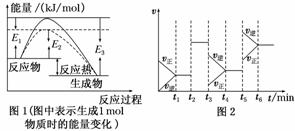
(1)根据图1请写出合成氨的热化学方程式
________________________________________________________________________
________________________________________________________________________
(热量用E1、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的________条件,该条件的改变与图2中哪一时刻条件的改变相同________(用“t1……t6”表示)。
(3)图2中t3时刻改变的条件是________________,t5时刻改变的条件是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0 (Ⅰ)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
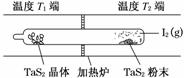
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为
________________________________________________________________________
________________________________________________________________________。
(4)25 ℃时,H2SO3HSO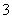 +H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中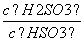 将________(填“增大”“减小”或“不变”)。
将________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在0℃1.01×105Pa下,对H2,O2,CH4三种气体叙述正确的是()
| A. | 其密度之比等于物质的量之比 | |
| B. | 其密度之比等于摩尔质量之比 | |
| C. | 等质量的三种气体,其体积之比等于相对分子质量的倒数比 | |
| D. | 等体积的三种气体,其物质的量之比等于相对分子质量之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验探究是体验知识的产生或形成过程的基本途径.下面是某同学探究实验报告的一部分,请填空:实验目的:氯、溴、碘的氧化性强弱比较
实验药品:NaCl溶液、KBr溶液、KI溶液、氯水、溴水、四氯化碳
| 实验步骤 | 结论 |
| ①NaCl溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序: 氯、溴、碘 |
| ②KBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 |
(1)完成该实验需用到的仪器是______;
(2)CCl4在实验中所起的作用是______;
(3)在实验②中四氯化碳层颜色变化过程为______;
(4)该同学的实验缺陷是______,改进的办法是______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com