
合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g) CO2(g)+4H2(g)已知,破坏1mol化学键需要吸收的热量如下表所示:
CO2(g)+4H2(g)已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
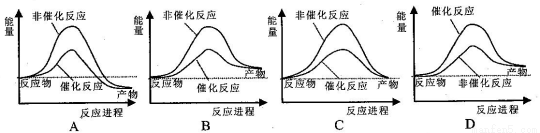
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
常温下Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,将等体积的AgCl和AgI的饱和溶液 的清液混合,再向其中加入一定量的AgNO3固体,下列说法正确的是( )
的清液混合,再向其中加入一定量的AgNO3固体,下列说法正确的是( )
A.两溶液混合,AgCl和AgI都沉淀
B.若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主
C.向AgI清液加入AgNO3,c(Ag+)增大,KSp(AgI)也增大
D.若 取0.1435克AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01mol/L
取0.1435克AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:填空题
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_____________________。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=_____________
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+ O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
C(s)+ O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJ•mol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____________。
(4)如图是N2和H2反应生成2molNH3过程中能量变化示意图:

①请计算每生成1molNH3放出热量为:_________.
②若起始时向容器内放入1molN2和3molH2达平衡后N2的为20%,则反应放出的热量为Q1kJ,则Q1的数值为_________.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
下列与金属腐蚀有关的说法正确的是
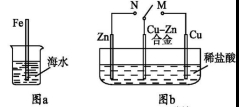
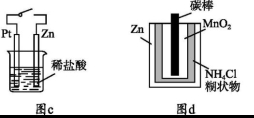
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
你认为下列行为中 有悖于“节能减排,和谐发展”这一主题的是( )
有悖于“节能减排,和谐发展”这一主题的是( )
A.将煤进行气化处理,提高煤的综合利用效率
B.研究采煤、采油新技术,提高产量以满足工业生产的快速发展
C.开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料
D.实现资源的“3R”利用观,即:减少资源消耗、增加资源的重复使用、资源的循环再生
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
在一恒容的密闭容器中充入2mol A和1mol B,发生反应2A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%。若维持容器中的容积和温度不变,按起始物质的量:A为0.6mol,B为0.3mol,C为1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则x的值为 ( )
xC(g),达到平衡后,C的体积分数为W%。若维持容器中的容积和温度不变,按起始物质的量:A为0.6mol,B为0.3mol,C为1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则x的值为 ( )
A.只能为2 B.只能为3 C.可能是2,也可能是3 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
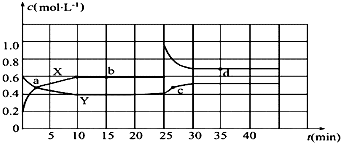
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com