
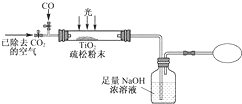
分析 (1)根据资料卡片中的TiCl4与SiCl4熔点、沸点判断TiCl4与SiCl4在常温下的状态,分离沸点相差较大的互溶液体常采取蒸馏方法;
(2)由信息可知TiCl4与水在加热条件下,水解得到沉淀TiO2•xH2O与HCl;
(3)由2O+H2O→2OH,可知水中O-H键断裂.非金属元素之间一般形成极性键;
(4)CxHy、CO等具有还原性,H2O2具有强氧化性;
(5)NaOH溶液增重16.5g为吸收的CO2质量,根据碳元素守恒可知,转化率的CO的物质的量等于CO2的物质的量为$\frac{16.5g}{44g/mol}$=0.375mol,依据转化率概念计算得到;
(6)装置中有残留的二氧化碳气体,通一会空气的目的是赶净装置中 的二氧化碳被氢氧化钠吸收,减少测定误差.
解答 解:(1)根据资料卡片中的TiCl4与SiCl4熔点、沸点可知,TiCl4与SiCl4在常温下的状态是液态,分离沸点相差较大的互溶液体常采取蒸馏方法,
故答案为:蒸馏;
(2)由信息可知TiCl4与水在加热条件下,水解得到沉淀TiO2•xH2O与HCl,反应方程式为:TiCl4+(x+2)H2O $\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl,
故答案为:TiCl4+(x+2)H2O $\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl;
(3)由2O+H2O→2OH,可知水中O-H键断裂,O-H键属于极性共价键,故答案为:极性共价键;
(4)CxHy、CO等具有还原性,H2O2具有强氧化性,H2O2能氧化CxHy、CO等,清除路面空气中的CxHy、CO等,故答案为:氧化性;
(5)22.4L(已折算成标准状况)CO气体的物质的量为 $\frac{22.4L}{22.4L/mol}$=1mol,NaOH溶液增重16.5g为吸收的CO2质量,根据碳元素守恒可知,转化率的CO的物质的量等于CO2的物质的量为$\frac{16.5g}{44g/mol}$=0.375mol,所以CO的转化率为$\frac{0.375mol}{1mol}$×100%=37.5%,故答案为:37.5%;
(6)装置中有残留的CO2气体,通一会儿空气,将残留在装置中的CO2气体排出,被NaOH溶液吸收,减小误差,
故答案为:将残留在装置中的CO2气体排出,被NaOH溶液吸收,减小误差.
点评 本题考查学生阅读题目获取信息能力、物质分离提纯等基本操作、对实验原理装置的理解等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | ②中水的电离程度的是①的8倍 | |
| B. | ①和③中水的电离程度相等 | |
| C. | 等体积的①和④混合后所得溶液中:c(NH3•H2O)<c(NH4+) | |
| D. | ②中水的电离程度等于④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①④⑥ | C. | ②③⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B的转化率均是20% | B. | x=4 | ||
| C. | 平衡时A的物质的量为3.2mol | D. | 平衡时气体压强比原来减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com