
”¾ĢāÄæ”æŌĖÓĆ»Æѧ·“Ó¦ŌĄķŃŠ¾æĢ¼”¢µŖµÄµ„ÖŹ¼°Ęä»ÆŗĻĪļµÄ·“Ó¦¶Ō»ŗ½ā»·¾³ĪŪČ¾”¢ÄÜŌ“Ī£»ś¾ßÓŠÖŲŅŖŅāŅ唣
(1)·“Ó¦¢ńFe(s)£«CO2(g) ![]() FeO(s)£«CO(g)””¦¤H1£¬Ę½ŗā³£ŹżĪŖK1£»
FeO(s)£«CO(g)””¦¤H1£¬Ę½ŗā³£ŹżĪŖK1£»
·“Ó¦¢ņFe(s)£«H2O(g) ![]() FeO(s)£«H2(g)””¦¤H2£¬Ę½ŗā³£ŹżĪŖK2£»
FeO(s)£«H2(g)””¦¤H2£¬Ę½ŗā³£ŹżĪŖK2£»
ŌŚ²»Ķ¬ĪĀ¶ČK1”¢K2ÖµČēĻĀ±ķ£ŗ
700 ”ę | 900 ”ę | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
¢ŁÓɱķÖŠÅŠ¶Ļ£¬·“Ó¦¢ńĪŖÖŠ¦¤H1______ (Ģī”°<”±»ņ”°=”±»ņ”°>”±) 0”£
¢Ś·“Ó¦CO2(g)£«H2(g) ![]() CO(g)£«H2O(g)””¦¤HĘ½ŗā³£ŹżĪŖK£¬ŌņK£½________(ÓĆK1ŗĶK2±ķŹ¾)”£
CO(g)£«H2O(g)””¦¤HĘ½ŗā³£ŹżĪŖK£¬ŌņK£½________(ÓĆK1ŗĶK2±ķŹ¾)”£
¢ŪÄÜÅŠ¶ĻCO2(g)£«H2(g) ![]() CO(g)£«H2O(g)“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ________(Ģī×ÖÄø)”£
CO(g)£«H2O(g)“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ________(Ģī×ÖÄø)”£
A.ČŻĘ÷ÖŠŃ¹Ēæ²»±ä B.»ģŗĻĘųĢåÖŠc(CO)²»±ä
C.vÕż(H2)£½vÄę(H2O) D.c(CO)£½c(CO2)
E.ČŻĘ÷ÄŚµÄĘųĢåĆÜ¶Č²»±ä F.»ģŗĻĘųĢåµÄĘ½¾łÄ¦¶ūÖŹĮæ²»±ä”£
(2)ŌŚ²»Ķ¬ĪĀ¶ČŗĶŃ¹ĒæĻĀŗĻ³É°±£¬ĘšŹ¼Ź±Ķ¶ČėµŖĘųŗĶĒāĘųµÄĪļÖŹµÄĮæ·Ö±šĪŖ1mol”¢3mol”£Ę½ŗāŹ±»ģŗĻĪļÖŠ°±µÄĢå»ż·ÖŹżÓėĪĀ¶ČµÄ¹ŲĻµČēĶ¼”£
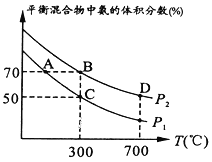
¢ŁP1_______P2 (Ģī”°>”±”°=”± ”°<”±»ņ”°²»Č·¶Ø”±£¬)”£
¢ŚCµćH2µÄ×Ŗ»ÆĀŹĪŖ________”£
”¾“š°ø”æ> ![]() BC < 66.7©
BC < 66.7©
”¾½āĪö”æ
(1)¢ŁĄūÓĆ»ÆŃ§Ę½ŗā³£ŹżÖ»ŹÜĪĀ¶ČµÄÓ°Ļģ£¬ÓėÅضČĪŽ¹Ų£¬Č»ŗóĄūÓĆĪĀ¶Č¶Ō»ÆŃ§Ę½ŗāŅʶÆÓ°Ļģ½ųŠŠ·ÖĪö£»
¢ŚĄūÓĆ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½½ųŠŠ·ÖĪö£»
¢ŪĄūÓĆ»ÆŃ§Ę½ŗāדĢ¬µÄ¶ØŅå½ųŠŠ·ÖĪö£»
(2)¢ŁĄūÓƵČĪŹĻĀ£¬Ń¹Ēæ¶Ō»ÆŃ§Ę½ŗāŅĘ¶ÆµÄÓ°Ļģ½ųŠŠ·ÖĪö£»
¢ŚĄūÓĆ”°Čż¶ĪŹ½·Ø”±½ųŠŠ¼ĘĖć£»
(1)¢Łøł¾Ż±ķøńÖŠŹż¾Ż£¬ĪĀ¶ČÉżøߣ¬K1Ōö“ó£¬ĖµĆ÷ÉżøßĪĀ¶Č£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬¼“”÷H1>0£»
¢Śøł¾Ż»ÆŃ§Ę½ŗā³£ŹżµÄ¶ØŅ壬K1=![]() £¬K2=
£¬K2=![]() £¬K=
£¬K=![]() ,ĶĘ³öK=
,ĶĘ³öK=![]() £»
£»
¢ŪA. øĆ·“Ó¦µÄĢŲµć£ŗ·“Ó¦Ē°ŗóĘųĢåĻµŹżÖ®ŗĶĻąµČ£¬¼“·“Ó¦Ē°ŗóĘųĢåĪļÖŹµÄĮæ²»±ä£¬“Ó¶ųĶĘ³öŃ¹Ēæ²»±ä£¬²»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗā£¬¹ŹA²»·ūŗĻĢāŅā£»
B. øł¾Ż»ÆŃ§Ę½ŗāדĢ¬µÄ¶ØŅ壬µ±c(CO)²»ŌŁøı䣬ĖµĆ÷·“Ó¦“ļµ½Ę½ŗā£¬¹ŹB·ūŗĻĢāŅā£»
C. vÕż(H2)±ķŹ¾ĻņÕż·“Ó¦·½Ļņ½ųŠŠ£¬vÄę(H2O)±ķŹ¾ĻņÄę·“Ó¦·½Ļņ½ųŠŠ£¬ĒŅH2ŗĶH2OµÄĻµŹżĻąĶ¬£¬vÕż(H2)£½vÄę(H2O)Äܹ»ĖµĆ÷·“Ó¦“ļµ½Ę½ŗā£¬¹ŹC·ūŗĻĢāŅā£»
D. ĶعżĮ½ÕßÅضČĻąµČ£¬²»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗā£¬¹ŹD²»·ūŗĻĢāŅā£»
E. ·“Ó¦Ē°ŗóĘųĢåĻµŹżÖ®ŗĶĻąµČ£¬Ņņ“ĖĘųĢå×ÜĢå»ż±£³Ö²»±ä£¬×é·Ö¶¼ŹĒĘųĢ壬ĘųĢå×ÜÖŹĮæ±£³Ö²»±ä£¬Ņņ“ĖĆÜ¶Č²»±ä£¬²»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗā£¬¹ŹE²»·ūŗĻĢāŅā£»
F. ·“Ó¦Ē°ŗóĘųĢåĻµŹżÖ®ŗĶĻąµČ£¬¼“ĘųĢåĪļÖŹµÄĮæ±£³Ö²»±ä£¬ĘųĢå×ÜÖŹĮæ±£³Ö²»±ä£¬Ņņ“ĖĘ½¾łÄ¦¶ūÖŹĮæ²»±ä£¬²»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗā£¬¹ŹF²»·ūŗĻĢāŅā£»
(2)¢ŁŗĻ³É°±µÄ·“Ó¦·½³ĢŹ½ĪŖN2£«3H2 ![]() 2NH3£¬ĻąĶ¬Ģõ¼žĻĀ£¬Ń¹ĒæŌ½“ó£¬Ę½ŗāĻņÕż·“Ó¦·½Ļņ½ųŠŠ£¬NH3Ģå»ż·ÖŹżŌö“󣬼“P2>P1£»
2NH3£¬ĻąĶ¬Ģõ¼žĻĀ£¬Ń¹ĒæŌ½“ó£¬Ę½ŗāĻņÕż·“Ó¦·½Ļņ½ųŠŠ£¬NH3Ģå»ż·ÖŹżŌö“󣬼“P2>P1£»
¢Ś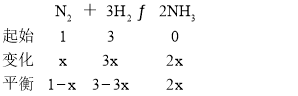 £¬Cµć°±µÄĢå»ż·ÖŹżĪŖ
£¬Cµć°±µÄĢå»ż·ÖŹżĪŖ![]() ”Į100%=50%£¬½āµĆx=
”Į100%=50%£¬½āµĆx=![]() £¬ŌņH2µÄ×Ŗ»ÆĀŹĪŖ
£¬ŌņH2µÄ×Ŗ»ÆĀŹĪŖ![]() ”Į100%”Ö66.7%”£
”Į100%”Ö66.7%”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĖ³”Ŗ1£¬2”Ŗ¶ž¼×»ł»·±ūĶéŗĶ·“”Ŗ1£¬2”Ŗ¶ž¼×»ł»·±ūĶéæÉ·¢ÉśČēĻĀ×Ŗ»Æ£ŗ

øĆ·“Ó¦µÄĖŁĀŹ·½³ĢæɱķŹ¾ĪŖ£ŗv£ØÕż£©=k£ØÕż£©”¤c£ØĖ³£©ŗĶv£ØÄę£©=k£ØÄę£©”¤c£Ø·“£©£¬k£ØÕż£©ŗĶk£ØÄę£©·Ö±š³Ę×÷Õż”¢Äę·“Ó¦ĖŁĀŹ³£Źż£¬ĖüĆĒŹÜĪĀ¶ČŗĶ“߻ƼĮÓ°Ļģ”£ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.ijĪĀ¶ČŹ±£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżæɱķŹ¾ĪŖK=![]()
B.Õż”¢Äę·“Ó¦ĖŁĀŹ³£ŹżøÄ±ä£¬Ę½ŗā³£ŹżŅ²Ņ»¶Ø»įĖęÖ®øıä
C.ČōÉżøßĪĀ¶Č£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬ŌņĖµĆ÷Õż·“Ó¦µÄ»ī»ÆÄÜøßÓŚÄę·“Ó¦µÄ»ī»ÆÄÜ
D.“߻ƼĮæÉŅŌøı䷓ӦĖŁĀŹµ«²»Ó°ĻģĘ½ŗā£¬ĖµĆ÷“߻ƼĮĶ¬µČ³Ģ¶Čøıäk£ØÕż£©ŗĶk£ØÄę£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij¹¤³§²ÉÓĆČēĶ¼×°ÖĆ“¦Ąķ»ÆŹÆČ¼ĮĻæŖ²É”¢¼Ó¹¤¹ż³Ģ²śÉśµÄH2S·ĻĘų£¬ŅŃÖŖµē½ā³ŲÖŠµÄĮ½øöµē¼«¾łĪŖ¶čŠŌµē¼«”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
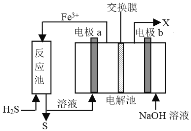
A.µē¼«aµē¼«·“Ó¦Ź½ĪŖFe2+- e-=Fe3+
B.øĆ×°ÖĆÄÜŹµĻÖÓÉH2S×Ŗ»ÆĪŖSŗĶH2
C.Čō½»»»Ä¤ĪŖÖŹ×Ó½»»»Ä¤£¬ŌņNaOHČÜŅŗµÄÅضČÖš½„±ä“󣬊čŅŖ¶ØĘŚøü»»
D.Čō½»»»Ä¤ĪŖŃōĄė×Ó½»»»Ä¤£¬bµē¼«Ēų»į²śÉśŗģŗÖÉ«³Įµķ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijæĘŃŠĶŶÓŃŠÖĘ³ö”°TM©LiH£ØTM±ķŹ¾¹ż¶É½šŹō£©”±Ė«“߻ƼĮĢåĻµ£¬ĻŌÖųĢįøßĮĖŌŚĪĀŗĶĢõ¼žĻĀµŖĘųŗĶĒāĘųŗĻ³ÉNH3µÄŠ§ĀŹ£¬ŌĄķŹ¾ŅāČēĻĀ£ŗ

ĻĀĮŠ·ÖĪö²»ŗĻĄķµÄŹĒ£Ø””””£©
A.דĢ¬¢ń£¬ĪüŹÕÄÜĮæ²¢ÓŠN”ŌN¼ü·¢Éś¶ĻĮŃB.ŗĻ³ÉNH3×Ü·“Ó¦µÄŌ×ÓĄūÓĆĀŹŹĒ100%
C.”°TM©LiH”±ÄܽµµĶŗĻ³É°±·“Ó¦µÄ”÷HD.Éś³ÉNH3£ŗ2LiNH+3H2ØT2LiH+2NH3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ŌĻĀĮŠĻÖĻó»ņŹĀŹµµÄ½āŹĶÕżČ·µÄŹĒ£Ø £©
Ń”Ļī | ĻÖĻó»ņŹĀŹµ | ½āŹĶ |
A | ÓĆČȵēæ¼īČÜŅŗČ„³żÓĶĪŪ | “æ¼īÓėÓĶĪŪÖ±½Ó·¢Éś·“Ó¦£¬Éś³ÉŅ×ČÜÓŚĖ®µÄĪļÖŹ |
B | Ź©·ŹŹ±£¬²ŻÄ¾»Ņ(ÓŠŠ§³É·ÖĪŖK2CO3)²»ÄÜÓėNH4Cl»ģŗĻŹ¹ÓĆ | K2CO3ÓėNH4Cl·“Ӧɜ³É°±Ęų»į½µµĶ·ŹŠ§ |
C | ĘÆ°×·ŪŌŚæÕĘųÖŠ¾ĆÖƱäÖŹ | ĘÆ°×·ŪÖŠµÄClO-æÉŅŌĖ®½ā³ÉHClO |
D | FeCl3ČÜŅŗæÉÓĆÓŚĖ®“¦Ąķ | FeCl3ÖŠFe3+¾ßÓŠŃõ»ÆŠŌæÉɱ¾śĻū¶¾ |
A.AB.BC.CD.D
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”滚²ńĶ·ÖŠŗ¬ÓŠČżĮņ»ÆĖÄĮ×£ØP4S3£©£¬ĖüŹĒŅ»ÖÖ»ĘÉ«¾§Ģ唣P4S3µÄ½į¹¹ŃŠ¾æ±ķĆ÷£¬øĆ·Ö×Ó֊ƻӊ²»±„ŗĶ¼ü£¬ĒŅø÷Ō×ÓµÄ×īĶā²ć¾ł“ļµ½ĮĖ8µē×Ó½į¹¹”£øĆ·Ö×ÓÖŠŗ¬ÓŠ¹²¼Ū¼üĢõŹżŹĒ£Ø £©
A.10øöB.9øöC.8øöD.7øö
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”湤ŅµÉĻÓĆNa2SO3ČÜŅŗĪüŹÕĮņĖį¹¤ŅµĪ²ĘųÖŠµÄSO2£¬²¢Ķعżµē½ā·½·ØŹµĻÖĪüŹÕŅŗµÄŃ»·ŌŁÉś”£ĘäÖŠŅõ”¢ŃōĄė×Ó½»»»Ä¤×éŗĻŃ»·ŌŁÉś»śĄķČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÖŠÕżČ·µÄŹĒ
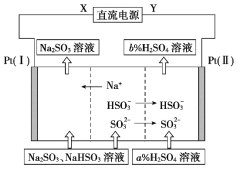
A.XÓ¦ĪŖÖ±Į÷µēŌ“µÄÕż¼«
B.µē½ā¹ż³ĢÖŠŅõ¼«ĒųpHÉżøß
C.Ķ¼ÖŠµÄb%£¼a%
D.SO32£ŌŚµē¼«ÉĻ·¢ÉśµÄ·“Ó¦ĪŖSO32££«2OH££2e£=SO42££«2H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
A.³£ĪĀ³£Ń¹ĻĀ£¬19gH3O+ŗ¬ÓŠ10NAøöµē×Ó
B.4.0gH218OÓėD2OµÄ»ģŗĻĪļÖŠĖłŗ¬ÖŠ×ÓŹżĪŖ2NA
C.±ź×¼×“æöĻĀ£¬22.4LCH4ŗĶC2H4µÄ»ģŗĻĘųĢåĖłŗ¬ĒāŌ×ÓŹżĪŖ4NA
D.ŗ¬3.0gHCHOµÄĖ®ČÜŅŗÖŠŌ×Ó×ÜŹżĪŖ0.4NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬½«pH¾łĪŖ3£¬Ģå»ż¾łĪŖV0µÄHAŗĶHBČÜŅŗ£¬·Ö±š¼ÓĖ®Ļ”ŹĶÖĮĢå»żV£¬pHĖę1g![]() µÄ±ä»ÆČēÓŅĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
µÄ±ä»ÆČēÓŅĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
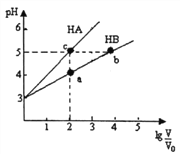
A. Ļ”ŹĶĻąĶ¬±¶ŹżŹ±£ŗc(A”„)>c(B”„-)
B. Ė®µÄµēĄė³Ģ¶Č£ŗb=c>a
C. ČÜŅŗÖŠĄė×Ó×ÜĪļÖŹµÄĮæ£ŗb>c>a
D. ČÜŅŗÖŠĄė×Ó×ÜÅØ¶Č£ŗa>b>c
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com