
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
| A.三者对应的氧化物均为碱性氧化物 |
| B.三者的单质放置在空气中均只生成氧化物 |
C.制备AlCl3、Fe Cl3、CuCl2均不能采用将溶液直接蒸干的方法 Cl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| D.AlCl3、FeCl3、CuCl2均可用作净水剂 |
科目:高中化学 来源: 题型:单选题
已知室温下,Al(OH)3的Ksp远大于Fe(OH)3。向浓度均为0.1mol/L的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积关系,合理的是( )
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用一小粒钠投入水中,实验操作和过程中不可能感知或观察到的现象是
| A.钠的熔点低 | B.钠呈银白色、硬度小 |
| C.钠有延展性,导电性好 | D.钠具有强还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法不正确的是( )
| A.干燥的氯气可以用钢瓶运输 |
| B.钠可以保存在CCl4液体中(已知:密度CCl4 > Na) |
| C.Na2O2可作为潜水艇的供氧剂 |
| D.实验后剩余的钠粒可放回原试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将ag镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L的氢氧化钠溶液,得到的沉淀量最大,质量为(a+1.7)g。下列说法不正确的是
| A.镁铝合金与盐酸反应转移电子总数为0.lNA | B.x=2y |
| C.沉淀是Mg(OH)2和Al(OH)3的混合物 | D.2x=y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸和制备氧化铁涂料。 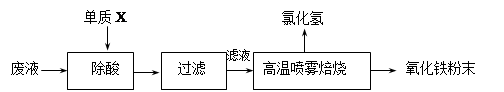
(1)单质X的化学式是 。
(2)氯化亚铁溶液经高温喷雾焙烧转化为HCl气体和氧化铁粉末,有关的化学方程式依次为: 。
(3)某铁红涂料中除含有Fe2O3外,还可能添加有CuO或FeO中的一种,请设计实验方案,探究该铁红涂料中添加物的成分。
① 提出合理假设
假设1:添加了CuO
假设2:添加了FeO
② 请设计方案,验证上述假设,写出实验步骤、预期现象和结论。
限选试剂:铁粉、3mol?L-1H2SO4、0.1 mol?L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
| 操作步骤 | 预期现象和结论 |
| 步骤1.取少量样品于试管中, ____________________________________________ | 样品全部溶解,得到澄清的溶液。 |
| 步骤2. 步骤3. | ___________________________ ___________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(18分)工业上以黄铜矿(主要成分CuFeS2)为原料制备CuSO2·5H2O的主要流程如下: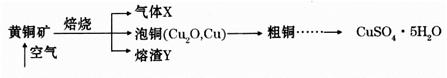
(1)下列装置可用于吸收气体X的是___________(填代号)。
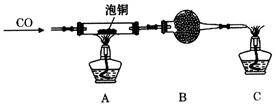
(2)某研究性学习小组用泡铜与CO反应来制取粗铜。
①装置B中的药品为_____________。
②实验时,依次进行如下操作:组装仪器、__________________、加装药品、通入气体、_____________________、点燃酒精灯。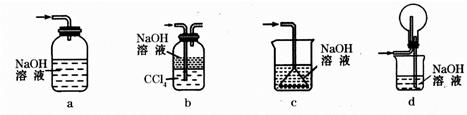
(3)熔渣Y的成分为Fe2O3和FeO,选用提供的试剂,设计实验验证熔渣中含有FeO。写出有关实验操作、现象与结论。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、氯水。
_______________________________________________________________________。
(4)向粗铜中加入硫酸和硝酸的混酸溶液制取硫酸铜时(杂质不参加反应),混酸中H2SO4与HNO3的最佳物质的量之比为___________________。
(5)用滴定法测定所得产品中CuSO4·5H2O的含量,称取a g样品配成100 mL溶液,取出20.00 mL,用c mol·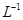 滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:
滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下: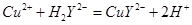 。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。
。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com