
| A.草木灰不宜与铵盐氮肥混合施用 | B.用醋酸清洗保温瓶里的水垢 |
| C.配置FeCl3溶液时加入适量的盐酸 | D.用热的纯碱溶液洗涤油污效果较好 |
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B.pH=3的一元酸HX溶液和pH =11的一元碱MOH溶液等体积混合: c(M+)=c(X)>c(H+)=c(OH-) |
| C.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液: c(CH3COO-)>c(CO32-)>c(C6H5O-) |
| D.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol/LNaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| B.室温下,向0.01mol/LNH4HSO4溶液中滴加等体积0.01mol/LNaOH溶液: c(Na+)=c(SO42-)>c(NH4+).>c(H+)>c(OH-) |
| C.Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) |
| D.25℃时,浓度均为0.1mol/L的CH3COOH和CH3COONa等体积混合: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
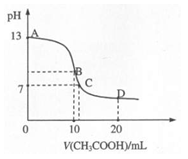
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 、H+、
、H+、 、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:



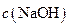
 (填“<”、“>”或“=”),混合前
(填“<”、“>”或“=”),混合前 溶液中的
溶液中的
 溶液中的
溶液中的 (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若Va=Vb,则混合后溶液pH=7 |
| B.若Va>Vb,则混合后溶液pH一定小于7 |
| C.若Va=Vb,则盐酸与氨水恰好完全中和 |
| D.若Va=Vb,混合后溶液中微粒浓度的关系可能为: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) |
| B.0.2mol/L的NaHSO4溶液中:c(Na+)>c(SO42-)> c(H+) > c(OH-) |
C.向NH4HCO3溶液中滴加NaOH溶液至中性:c(NH4+)+c(Na+)= c (HCO3-)+c(CO32-) (HCO3-)+c(CO32-) |
| D.0.1 mol/L pH=9的NaNO2溶液中:c(Na+)>c(NO2-)>c(OH-) >c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com