
 酒后驾车已成为一个社会问题,2013年1月1日起执行的新交规对酒后驾车作出严厉的处罚规定.检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.
酒后驾车已成为一个社会问题,2013年1月1日起执行的新交规对酒后驾车作出严厉的处罚规定.检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.| 10-7×0.01 | ||
|
| 2×10-9 |
| (c-0.02) |
| 2×10-9 |
| (c-0.02) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
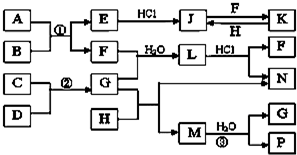 如图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去).
如图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| U | ||
| Y |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入He的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②①③④ | B、①②③④ |
| C、③②①④ | D、②①④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
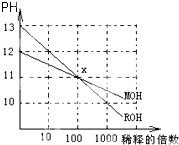 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )| A、等PH的MOH和ROH溶液,稀释相同倍数,ROH 溶液的PH略大 |
| B、稀释前,c(ROH)=10c(MOH) |
| C、常温下pH之和为14的醋酸和ROH溶液等体积混合,溶液呈碱性 |
| D、在x点,c(M+)=c(R+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
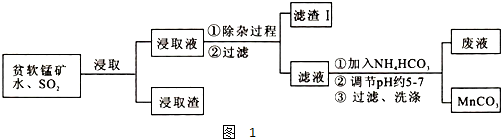
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化铝 | 3.3 | 5.2 |
| 氢氧化亚铁 | 7.6 | 9.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com