
����Ŀ��ȡһ�����ʵ���Ũ�ȵ�NaOH��Һ100mL��Ȼ������ͨ��һ������CO2���壬�õ���ҺA����A����λ�������0.1mol/L��HCl��Һ��������CO2�����������״����������HCl��Һ�����֮���ϵ��ͼ��ʾ��ͨ������ش�
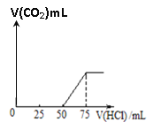
��1��A��Һ�е�����Ϊ_________����ѧʽ���������ʵ���֮����_______��
��2��ͨ��CO2�������__________________����״������
��3��NaOH��Һ�����ʵ���Ũ��______________________��
��4������ͨ���CO2����Ϊ112mL, �����õ���Һ��λ�������0.1mol/L��HCl��Һ������������CO2�����������״�����Ĺ�ϵͼ________________����Ӧ���ֹؼ�������ݣ�
���𰸡�NaOH��Na2CO3 1��1 56 mL 0.075mol/L 
��������
��1��CO2��NaOH��Һ��Ӧ���������֡��߽硱�������CO2+2NaOH= Na2CO3+H2O���� CO2+NaOH=NaHCO3���ʷ�Ӧ����Һ�����ʵijɷֿ������¿��ܣ�Na2CO3��NaOH��Na2CO3��Na2CO3��NaHCO3��NaHCO3������ϡ������εε�̼������Һ��ʱ��Na2CO3������ķ�Ӧ�Ƿֲ����еģ�Na2CO3+HCl=NaHCO3+NaCl��, NaHCO3+HCl=NaCl+H2O+CO2���ܣ����ҿ��Կ���������Ӧ��ȫ����ʱ��������������HCl������ȣ�����Һ�л����������ƣ������ȷ�����Ӧ��NaOH+HCl=NaCl+H2O �ݣ��跴Ӧ����CO2֮ǰ������������ΪV1���ӿ�ʼ����CO2����Ӧ����������������ΪV2�������ַ�Ӧ������ܽ������

���ͼ����з������⣨1����2����3����
��4��������̼����������ǡ����ȫ��Ӧ����̼���ƺ�̼�����Ʒ�Ӧ������̼ԭ�ӡ��������غ��з��̣����̼���ƺ�̼�����Ƶ����ʵ��������Һ�м������ᣬ̼���ƺ����ᷴӦ����̼�����ƣ�ԭ�еĺ������ɵ�̼���������������ᷴӦ���ɶ�����̼���������������̼�����������ݴ˻�����Ӧ��ͼ��
CO2��NaOH��Һ��Ӧ���������֡��߽硱�������CO2+2NaOH= Na2CO3+H2O�� �� CO2+NaOH=NaHCO3���ʷ�Ӧ����Һ�����ʵijɷֿ������¿��ܣ�Na2CO3��NaOH��Na2CO3��Na2CO3��NaHCO3��NaHCO3������ϡ������εε�̼������Һ��ʱ��Na2CO3������ķ�Ӧ�Ƿֲ����еģ�Na2CO3+HCl=NaHCO3+NaCl��, NaHCO3+HCl=NaCl+ H2O+CO2���ܣ����ҿ��Կ���������Ӧ��ȫ����ʱ��������������HCl������ȣ�����Һ�л����������ƣ������ȷ�����Ӧ��NaOH+HCl=NaCl+H2O �ݣ��跴Ӧ����CO2֮ǰ������������ΪV1���ӿ�ʼ����CO2����Ӧ����������������ΪV2�������ַ�Ӧ������ܽ������

�������е�ͼ��
��1��V1=50��V2=50-25=25mL<V1���ݴ��ж���Һ�����ʵijɷ���NaOH��Na2CO3�����������ݢۢ�������ѧ����ʽ��֪��n(NaOH)��n(Na2CO3)=(75-50):25=1:1��
�������������������NaOH��Na2CO3��1:1��
��2��50mL~75mL�����ķ�ӦΪHCO3-+H+=H2O+CO2����n(HCl)=0.025��0.1=0.0025mol�����ݷ�Ӧ��ϵ��֪��V(CO2)=0.0025��22.4=0.056L=56mL��
�������������������56 mL��
��3������������75mLʱ����Һ����ΪNaCl����ʱn(Na+)= n(HCl)=0.075��0.1=0.0075mol������n(NaOH)=0.0075mol,c(NaOH)=0.0075/0.1=0.075mol/L��
�������������������0.075mol/L��
��4��CO2����Ϊ112mL�����ʵ���Ϊ0.005mol�����������Ʒ�����Ӧ����̼���ƺ�̼�����ƣ�������̼����Ϊxmol������̼������Ϊymol������̼ԭ���غ㣺x+y=0.005mol,�������غ㣺2x+y=0.075��0.1=0.0075��ͨ�������֪x=0.0025mol��y=0.0025mol��̼���ƺ�̼�����ƵĻ��Һ�м������ᣬ̼���������ᷴӦ����̼�����ƣ�����Na2CO3+HCl=NaHCO3+NaCl��֪��������������Ϊ��V(HCl)=0.0025/0.1=0.025L=25mL�����ɵ�̼�����ƺ�ԭ�е�̼�����ƹ���0.0025+0.0025=0.005mol������NaHCO3+HCl=NaCl+ H2O+CO2����Ӧ��֪�����ɶ�����̼�����Ϊ��0.005��22.4=0.112L=112mL�������Ϸ������Ի���̼���ƺ�̼�����ƻ����Һ����λ�������0.1mol/L��HCl��Һ����������CO2�����������״�����Ĺ�ϵͼ���£�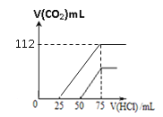 ������������������ǣ�
������������������ǣ� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ÿ������һϵ��ʵ�飨ͼ�мг�װ������ȥ��

��ش��������⣺
��. ������a��Cl2��װ��A��B��C�е��Լ�����Ϊ�� FeCl2��Һ������KI��Һ��ʯ����Һ��
��1��A��Һ��dz��ɫ��Ϊ�ػ�ɫ����Ӧ�����ӷ���ʽΪ_________________________________��
��2��Bƿ�еĵ���KI��Һ��Ϊ��ɫ����Ӧ�����ӷ���ʽΪ______________________________��
��3��Cƿ�е�����Ϊ_______________________________________________________________��
��4��Dװ�����Լ�Ϊ_______________________________________________________________��
II��������a��SO2��װ��A��B��C�е��Լ�����Ϊ��Ʒ����Һ�����Ը��������Һ�������ᣨ�����ˮ��Һ����
��1��Aƿ��Ʒ���Bƿ�����Ը��������Һ����ɫ������������SO2Ư���Ե��� _____����д���A��B����
��2��Cƿ�в�������ɫ������ ��Ӧ�Ļ�ѧ����ʽ_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ݰ�½�ȵ���ʢ�����ӣ�����Ҷ��������ƽ������Ѫ���١�ֹʹ�����ã���һ��������ҩ�ġ�������Ҷ���Գɷֻ�ͪ�����ʵ���ȡ���õļ������ܼ���ȡ�����������������ᾧ������������ȡ���ȡ����й��ڷ����ᴿʵ�������Ͳ�����ȷ����
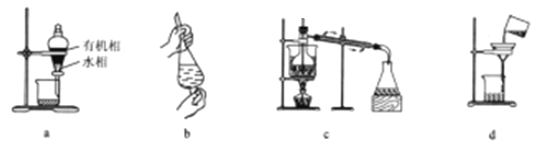
A. ��װ��a��Һ���ų�ˮ����ٴӷ�Һ©���¿ڷų��л���
B. ����b:�����ʹֲ�Ʒ������Ҷ�з���������л��ܼ���ȡ���е���Ч�ɷ��������в�ʱ����������ʹ©��������ų�
C. ��װ��c����������������л��ܼ������ȥ�õ�����Ҷ��Ч�ɷֻ�ͪ������
D. �ᾧ������װ��d���������ܼ����뿪
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ���ò�ͬ����������֮��ļ����ͼ��ܵ����ݣ�
O��O�� ���� | O | O | O2 | O |
����(10��12 m) | 149 | 128 | 121 | 112 |
����(kJ��mol��1) | x | y | z��494 | w��628 |
����x��y�ļ���������δ�ⶨ�����ɸ��ݹ������Ƶ����ܵĴ�С˳��Ϊw>z>y>x���ù�������
A���ɼ��ĵ�����Խ�࣬����Խ��
B������Խ��������ԽС
C���ɼ����õĵ�����Խ�٣�����Խ��
D���ɼ�ʱ���Ӷ�Խƫ�ƣ�����Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϊ�ⶨ��������Ʒ�������� Na2O�����Ƶ��ʵ��������������������ʵ�飨��Ӧװ����ͼ��ʾ����

�ٳ��� A��B ��������
�ڳ�ȡһ������������Ʒ
�۽�����ƷͶ����ƿ�У�Ѹ�������� U �θ���ܣ��ں���ˮ CaCl2 ���� ��������Ƥ�� ���й������ǣ���ȡ�Ľ�������Ʒ����Ϊ a g��A��B ��Ӧǰ������Ϊ b g����Ӧ�� A��B ��������Ϊ c g�� ���������ش��������⣺
��1��A ���ƺ�ˮ��Ӧ���̿ɿ������۳�������С������һ����ԭ���ǣ�_____________
��2���� a��b��c ��ʾ���Ƶ��ʵ���������Ϊ_______________
��3�����û�� B װ�ö�ʵ�����к�Ӱ��___________�����ƫ��ƫС������Ӱ�족��
�����ý����ƺͿ����Ʊ����Ƚϸߵ� Na2O2�������õ�װ������ͼ���ش��������⣺


��4������װ�â���ʢ�ŵ��Լ���______��Ϊ���ʵ��Ӧ��װ�â�����_____����д��ĸ�ţ���
A��I ֮ǰ B�� I �� II ֮�� C�� II �� III ֮�� D��III ֮��
��5����ȼ�ƾ��ƺ۲쵽װ�� II �е�����Ϊ_____��
�������Ƶô��Ƚϸߵ� Na2O2�������ʵ�顣�ش��������⣺
��6������֬�ް�סNa2O2��ĩ������ʯ�����ϣ�ͨ��ϸ������֬���д�CO2����֬��_______(��ܡ����ܡ�)ȼ��������
��7��ʢ��0.78 g Na2O2��1.68g NaHCO3�Ĺ�����������ܱ������м���,����������Ϊ_________g.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:2CH3COCH3(1)![]() CH3COCH2COH(CH3)2(1)��ȡ����CH3COCH�ֱ���0����20���·�Ӧ,�����ת����(��)��ʱ��(t)�仯�Ĺ�ϵ��������ͼ��ʾ������˵����ȷ����
CH3COCH2COH(CH3)2(1)��ȡ����CH3COCH�ֱ���0����20���·�Ӧ,�����ת����(��)��ʱ��(t)�仯�Ĺ�ϵ��������ͼ��ʾ������˵����ȷ����
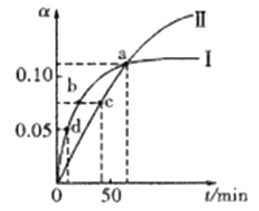
A. ��������ʾ20��ʱ��ת����Ӧ
B. �����¶�����߷�Ӧ���ƽ��ת����
C. ��a��ʱ,������������ʾ��Ӧ�Ļ�ѧƽ�ⳣ�����
D. ��ѧ��Ӧ���ʵĴ�С˳��Ϊ:d>b>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ƿ�չ�е�����Դ���������ð����ȵ��Ʊ���Ӧ�õȻ��ڡ��ش���������:
��1���������Ʊ�
��̫����Ϊ��Դ���Ȼ�ѧ���ѭ���ֽ�ˮ��һ�ָ�Ч������Ⱦ�����ⷽ�����䷴Ӧ������ͼ��ʾ��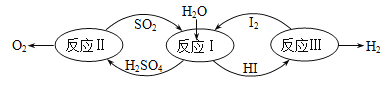
��Ӧ������������Ӧ:
��H2SO4(1)=SO3(g)+H2O(g) ��H=177kJ/mol
��2SO3(g)=2SO2(g)+O2(g) ��H=196kJ/mol
д����Ӧ�����Ȼ�ѧ��Ӧ����ʽ__________
��2��������Ӧ��
CO2�����Ʊ�����(HCOOH)�����ڻ�������CO2���¶�ΪT1ʱ���������ʵ�����CO2��H2�������Ϊ1L���ܱ������з�����Ӧ:CO2(g)+H2(g)![]() HCOOH(g) ��H,��ѧƽ�ⳣ��K=1
HCOOH(g) ��H,��ѧƽ�ⳣ��K=1
ʵ����:v��=k����c(CO2)��c(H2), v��=k����c(HCOOH),k����k��Ϊ���ʳ�����
�ٵ�CO2��ת����Ϊ33.3%ʱ��HCOOH���������Ϊ_____(��������)��
��T1ʱ��k��=_________(��k����ʾ)���������¶���T2ʱ��k��=0.9k��������H____0(����>������<"����=��)��
�۲��õ绹ԭ��Ҳ�ɽ�CO2ת��Ϊ���������SnΪ������PtΪ������KHCO3��ҺΪ���Һ���е�⡣CO2Ӧͨ��______��(��������������������)����缫��ӦʽΪ__________
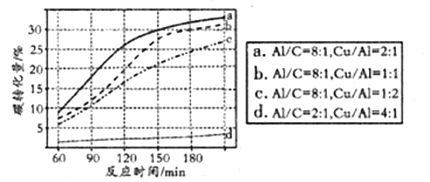
�ܿ���NaHCO3����CO2��Ϊ̼Դ�����Ʊ����ᡣ��Ӧ���м���NaHCO3ˮ��Һ��A1�ۡ�Cu�ۣ���300���·�Ӧ��NaHCO3����һ��ʱ��Al��Cu��������̼ת����Ӱ������ͼ����ͼ��֪������d���������������̼ת�����仯�������Ҫԭ����__________����̼ת����Ϊ30%ʱ�����õ�ʵ��������____________��
 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
�������뺣���������γ�ͨ���뽺��������й�
�ڡ���������ʹ�õ����ᱵ���������
�����ɱ����Ǵ��������ǻ�����
���������ܽ����������¿ɹ۲쵽���������
��ij��ɫ��Һ�м���ϡ���ᣬ�����������ʹ����ʯ��ˮ����ǣ���ԭ��Һ��һ����CO![]()
����������������Fe(OH)3�����KCl��Һ
A. �٢ۢܢ� B. �٢ۢܢ� C. �٢ۢܢݢ� D. �٢ڢۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1mol/LNaOH��Һ�ֱ�μӵ�0.1mol/LHA��Һ��HB��Һ��,�������Һ������Ũ����pH�ı仯��ϵ��ͼ��ʾ������˵������ȷ����
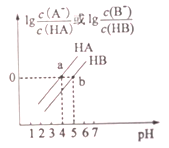
A. Ka(HB)<Ka(HA)
B. a��ʱ,c(A-)=c(HA)>c(Na+)>c(H+)>c(OH-)
C. ������,0.1mol/LNaA��Һ��pH����0.1mol/LNaB��Һ��pH
D. ��HB��Һ�м���NaOH��Һ,�����Һ��c(B-)/c(HB)=10[pH-pKa(HB)](��֪:pKa=-lgKa)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com