
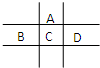
 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:| 3.36L |
| 22.4L/mol |
| 3.36L |
| 22.4L/mol |
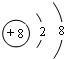 ,故答案为:
,故答案为: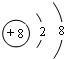 ;
;

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铵盐是一类重要的化合物,应用广泛,如NH4Al(SO4)2可用作净水剂、食品添加剂等;NH4HSO4用于定量分析、医药和电子工业中.请回答下列问题:
铵盐是一类重要的化合物,应用广泛,如NH4Al(SO4)2可用作净水剂、食品添加剂等;NH4HSO4用于定量分析、医药和电子工业中.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A、Mg 电极是该电池的负极 |
| B、H2O2在石墨电极上发生氧化反应 |
| C、石墨电极附近溶液的pH减小 |
| D、溶液中Cl-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的最高价含氧酸的分子式可表示为H3XO4 |
| B、X是第二周期VA族元素 |
| C、X是第二周期VIA族元素 |
| D、X的最高化合价为+4价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚乙烯塑料的老化是由于发生了加成反应 |
| B、淀粉,油脂和蛋白质都是高分子化合物 |
| C、“地沟油”禁止食用,但可以用来制造肥皂或生物柴油 |
| D、CO2,CH4,N2等均是造成温室效应的气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com