
| A. | Al3+、NO3-、K+、SO42- | B. | Cu2+、Ba2+、SO42-、CO32- | ||
| C. | OH-、Cl-、NH4-、Na+ | D. | Mg2+、Na+、SO42-、NO3- |
分析 A.浓度相等时不满足电荷守恒;
B.铜离子与碳酸根离子反应,钡离子与硫酸根离子、碳酸根离子反应;
C.氢氧根离子与铵根离子反应;
D.四种离子之间不反应,浓度相等时满足电荷守恒.
解答 解:A.该组离子之间不反应,可大量共存,但溶液中四种离子的浓度均为1mol•L-1,不满足电荷守恒,故A错误;
B.Ba2+与SO42-、CO32-反应,Cu2+、CO32-反应,在溶液中不能共存,无法配制该溶液,故B错误;
C.OH-、NH4+之间发生反应,在溶液中不能大量共存,无法配制该溶液,故C错误;
D.该组离子之间不反应,可大量共存,且溶液中四种离子的浓度均为1mol•L-1,满足电荷守恒,故D正确;
故选D.
点评 本题考查离子的共存的判断与应用,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,注意电荷守恒的应用方法,试题培养了学生的分析能力及灵活应用能力.


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
 二氧化氯被世界卫生组织(WHO)确认为第四代A1型消毒剂.
二氧化氯被世界卫生组织(WHO)确认为第四代A1型消毒剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
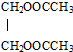 (过程中无机产物已忽略)
(过程中无机产物已忽略) .
.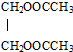 的反应方程式CH3COOH+HOCH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$
的反应方程式CH3COOH+HOCH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$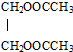 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肉桂酸(
肉桂酸(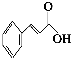 )在化妆行业及香料行业中属于明星物质,而且其需求量愈来愈大,如图是该物质的合成及其应用.根据图示回答下列问题:
)在化妆行业及香料行业中属于明星物质,而且其需求量愈来愈大,如图是该物质的合成及其应用.根据图示回答下列问题: ,其分子中所有的碳原子是否可能处于同一个平面?可能(填“可能”或“不可能”).
,其分子中所有的碳原子是否可能处于同一个平面?可能(填“可能”或“不可能”).  +
+ $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定条件下,某些化学反应可以如图框架表示(未注明反应条件),根据要求回答下列问题:
在一定条件下,某些化学反应可以如图框架表示(未注明反应条件),根据要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间变化 | B. | V正(X)=2V逆(Z) | ||
| C. | 容器内X、Y、Z的浓度相等 | D. | 容器内气体密度不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com