
已知有:
(l)H2(g)+ O2(g)=H2O(g);△H1=akJ·
O2(g)=H2O(g);△H1=akJ·
(2)H2(g)+O2(g)=2H2O(g);△H2=bkJ·
(3)H2(g)+ O2(g)=H2O(l);△H3=ckJ·
O2(g)=H2O(l);△H3=ckJ·
(4)H2(g)+O2(g)=2H2O(l);△H4=dkJ·
下列关系式中正确的是
A.a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>0
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源:2016-2017学年山西省高二上11月月考化学卷(解析版) 题型:填空题
已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在溶解平衡.当达到平衡时,溶液中离子浓度的乘积是一个常数(此常数用Ksp表示,Ksp和水的KW相似).如:
AgX(s) Ag+(aq)+X-(aq);Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
Ag+(aq)+X-(aq);Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
AgY(s) Ag+(aq)+Y-(aq);Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
Ag+(aq)+Y-(aq);Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
AgZ(s) Ag+(aq)+Z-(aq);Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
Ag+(aq)+Z-(aq);Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量/1 L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为 。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-) (填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188 g的AgY(相对分子质量为188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为 。
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由: ②在上述(3)体系中,能否实现AgY向AgX的转化?根据你的观点选答一项.若不能,请简述理由: ,若能,则实验转化的必要条件是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上期中理化学卷(解析版) 题型:选择题
下列叙述正确的是
A.pH=3和pH=4的盐酸各10ml混合,所得溶液的pH=3.5
B.溶液中c(H+)越大,pH值也越大,溶液的酸性就越强
C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆哈密二中高二上期中化学试卷(解析版) 题型:选择题
在一密闭容器中进行反应:X2(g)+Y2(g)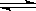 2Z(g),若X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡状态时,下列说法正确的是
2Z(g),若X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡状态时,下列说法正确的是
A.Z的浓度可能为0.3mol/L
B.平衡时X2、Y2的转化率相等
C.平衡时,Y2和Z的生成速率之比为2:1
D.若平衡后再改变外界条件,升高温度,则反应的平衡常数 将变大
将变大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆哈密二中高二上期中化学试卷(解析版) 题型:选择题
对于可逆反应:2SO2(g)+O2(g) 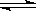 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
A.增大压强 B.升高温度 C.使用催化剂 D.多充入O2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高一期中化学卷(解析版) 题型:填空题
(1)19g某金属氯化物ACl2中含有0.4molCl-离子,则ACl2的摩尔质量是____________, A的相对原子质量是___________。
(2)同温同压下,质量相同的五种气体:①CO2②H2③O2④CH4⑤SO2,所占体积由大到小的顺序是(填序号,下同) ; 密度由大到小的顺序是 。
(3)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体的平均摩尔质量为 。
(4)VmLAl2(SO4)3溶液中含Al3+ ag,取V/4mL溶液稀释到VmL,则稀释后溶液中SO42-的物质的量浓度是 mol/L。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高一期中化学卷(解析版) 题型:选择题
在强酸性无色透明溶液中,下列各组离子能大量共存的是
A.Fe3+、K+、Cl-、NO3- B.Ag+、Na+、NO3-、Cl-
C.Zn2+、Al3+、SO42-、Cl- D.Ba2+、NH4+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高二期中化学卷(解析版) 题型:填空题
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知 :CO(g)+H2O(g)
:CO(g)+H2O(g) H2(g)+CO2(
H2(g)+CO2( g)的平衡常数随温度
g)的平衡常数随温度 的变化如下表:
的变化如下表:
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)上述反应平衡常数的表达式为 _____________,正反应是___________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率___________(填“增大”“减小”或“不变”),容器内混合气体的压强______________(填“增大”“减小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 ____________ (选填字母)。
A | B | C | D | |
n(CO2)/mol | 3[ | 1 | 0 | 1 |
n(H2)/mol | 2 | 1 | 0 | 1 |
n(CO)/mol | 1 | 2 | 3 | 0.5 |
n(H2O)/mol | 5[ | 2 | 3 | 2 |
(4)830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
苯甲酸钠(NaA)可作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2。已知25 ℃时,HA、H2CO3的电离平衡常数分别为 K=6.25×10-5、 K1=4.3×10-7,则下列说法正确的是(不考虑饮料中其他成分) ( )
A.提高CO2充气压力,饮料中c(A-)不变
B.当pH为5.0时,饮料中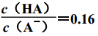
C.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
D.结合H+的能力:A-> HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com