
(14分).硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和 。
(2)为检验分解产物的成份,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
① A中固体充分加热较长时间后,通入氮气,目的是 。
②为验证A中残留物是否含有FeO,需要选用的试剂有 。
A.KSCN溶液 B.稀硫酸
C.浓盐酸 D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有 气体生成,若含有该气体,观察到的现象为 。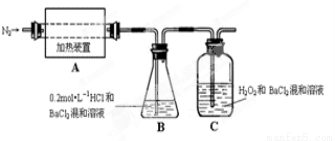
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则b a(填“大于”、“小于”或“等于”)
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为
(用离子方程式表示)。
(3)已知亚铁离子被氧气氧化的反应是:4Fe2+ + O2 + (4+2x) H2O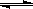 2Fe2O3?xH2O + 8H+,硫酸亚铁铵溶液较硫酸亚铁溶液不易被氧气氧化,其原因是 。
2Fe2O3?xH2O + 8H+,硫酸亚铁铵溶液较硫酸亚铁溶液不易被氧气氧化,其原因是 。
(每空2分)(1)SO2
(2) ①使分解产生的气体在B、C中被充分吸收
②CD
③SO3 溶液变浑浊
④小于
⑤SO2+H2O2+Ba2+=BaSO4↓+2H+
(3)硫酸亚铁铵溶液中NH4+发生水解增大c(H+),抑制了上述氧化还原反应的进行
【解析】
试题分析:(1)根据氧化还原反应过量,Fe、N元素的化合价均升高,则一定有降低的元素,从所给的产物判断,产物中还应有SO2;
(2)①氯化钡与稀盐酸的混合液目的是吸收氨气、三氧化硫,则过氧化氢和盐酸的混合液主要吸收二氧化硫,所以通入氮气的目的是使分解产生的气体在B、C中被充分吸收
②为验证A中残留物是否含有FeO,则选择浓盐酸将固体溶解,然后加入酸性高锰酸钾溶液,若溶液褪色或变浅,证明溶液中含有亚铁离子,则固体中含有FeO,所以答案选CD;
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有三氧化硫,若含有三氧化硫,则溶液中有硫酸钡沉淀生成,溶液变浑浊;
④若产物中有氮气生成,则失去电子的元素是Fe和N,得到电子的元素是S,根据得失电子守恒,生成bmolFe2O3失去电子的物质的量是2bmol,C中沉淀物质的量为amol,即生成的二氧化硫的物质的量是amol,则得电子的物质的量是2amol,所以2b<2a,b<a;
⑤C中的白色沉淀是硫酸钡沉淀,二氧化硫与过氧化氢、氯化钡溶液发生氧化还原反应而生成硫酸钡沉淀,离子方程式为SO2+H2O2+Ba2+=BaSO4↓+2H+
(3)亚铁离子被氧化后的溶液显酸性,硫酸亚铁铵溶液中NH4+发生水解增大c(H+),抑制了上述氧化还原反应的进行。
考点:考查物质的化学性质,反应产物的判断,氧化还原反应规律的应用,离子方程式的书写


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:填空题
设反应①Fe(s)+CO2(g)  FeO(s)+CO(g) ΔH=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)??
FeO(s)+CO(g) ΔH=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)?? FeO(s)+H2(g) ΔH=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) ΔH=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
温度(T) | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
(1)从上表可推断,反应①是________(填“放”或“吸”)热反应。
(2)现有反应③H2(g)+CO2(g)? CO(g)+H2O(g) ΔH=Q的平衡常数为K3。
CO(g)+H2O(g) ΔH=Q的平衡常数为K3。
Ⅰ.根据反应①与②推导出K1、K2、K3的关系式K3=___ _____;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有________。
A.缩小容器体积 B.降低温度
C.使用合适的催化剂 D.设法减少CO的量
E.升高温度
Ⅱ.根据反应①与②推导出Q1、Q2、Q3的关系式Q3=________。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省协作体高三第一次适应性测试理科综合化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.向Na2CO3溶液通入CO2,可使水解平衡:CO32 -+H2O HCO3- +OH-向正反应方向移动,则溶液pH增大
HCO3- +OH-向正反应方向移动,则溶液pH增大
B.室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4
C.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA
D.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH值
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:选择题
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl = Na2Mn5O10+2AgCl 下列“水” 电池在海水中放电时的有关说法正确的是( )
A.正极反应式:Ag+Cl--e-== AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:选择题
下列各组物质的性质比较,正确的是( )
A.熔点:CO2<H2O<SiO2<KCl B.粒子半径:K+>Na+>Mg2+>Al3+
C.酸性:H3PO4>H2SO4>HClO4>H2SiO3 D.稳定性:H2O<NH3<PH3<SiH4
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版) 题型:选择题
一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g),则下列说法正确的是
CH3OCH3(g)+H2O(g),则下列说法正确的是
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 |
|
|
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A、该反应的正方应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版) 题型:选择题
下列表格中的各种情况,可以用下面的图象曲线表示的是
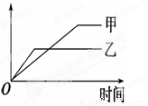
| 反应 | 纵坐标 | 甲 | 乙 |
A | 等质量的钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
B | 相同质量氨,在同一容器中2NH3 | 氨气的转化率 | 500℃ | 400℃ |
C | 在体积可变的恒压容器中,体积比1:3的N2、H2,2NH3 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
D | 2molSO2与1molO2,在相同温度下2SO2+O2 | SO3物质的量 | 10个大气压 | 2个大气压 |
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三上学期期中联考化学试卷(解析版) 题型:选择题
工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
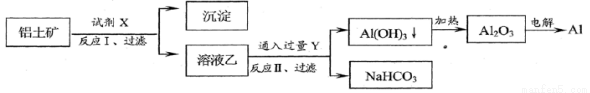
对上述流程中的判断正确的是( )
A.试剂X为稀硫酸
B.结合质子( H+)的能力由强到弱的顺序是:AlO2- > OH->CO32-
C.反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com