
| 实验现象 | 原因 |
| 溶液逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为黄绿色 | 继续通入的氯气溶于水使溶液呈黄绿色 |
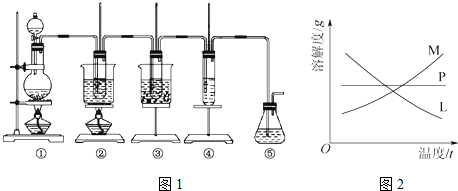
分析 (1)实验室制备氯气用浓盐酸和二氧化锰在加热条件反应,所用反应仪器为分液漏斗和圆底烧瓶,可用饱和食盐水除杂;
(2)在加热条件下,氯气与浓KOH溶液反应生成氯酸钾,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠,溶质的溶解度随温度的降低而降低;
(3)氯气在常温下与NaOH反应生成次氯酸钠和氯化钠;
(4)氯气与水反应生成盐酸和次氯酸,反应生成的H+使石蕊变成红色,次氯酸具有强氧化性,将石蕊氧化为无色物质,所以反应现象为先变红,后褪色,反应后如继续通入氯气,氯气微溶于水,则为氯气的溶液,溶液呈黄绿色.
解答 解:(1)实验室制备氯气用浓盐酸和二氧化锰在加热条件反应,所用反应仪器为分液漏斗和圆底烧瓶,生成氯气混有HCl气体,根据氯气难溶于饱和氯化钠溶液,HCl易溶于水,可用饱和食盐水除杂,
故答案为:分液漏斗;B;
(2)根据题中信息可知,在加热条件下,氯气与浓KOH溶液反应生成氯酸钾,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠,二者反应的浓度和温度都不相同,反应完毕经冷却后,②的试管中有大量晶体析出,说明溶质的溶解度随温度的降低而降低,只有M符合,不溶性固体与液体的分离常采用过滤的方法,
故答案为:碱溶液(或反应物)的浓度不同,反应温度不同;M;过滤;
(3)氯气在常温下与NaOH反应生成次氯酸钠和氯化钠,二者在水中溶解且电离,反应的离子方程式为Cl2+2OH-═ClO-+Cl-+H2O,
故答案为为:Cl2+2OH-═ClO-+Cl-+H2O;
(4)氯气与水反应生成盐酸和次氯酸,反应生成的H+使石蕊变成红色,次氯酸具有强氧化性,将石蕊氧化为无色物质,所以反应现象为先变红,后褪色,反应后如继续通入氯气,氯气微溶于水,则为氯气的溶液,溶液呈黄绿色.
故答案为:
| 实验现象 | 原因 |
| 红 | |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 黄绿 | 继续通入的氯气溶于水使溶液呈黄绿色 |
点评 本题考查对装置的分析评价、物质的分离提纯、对实验现象的分析等知识点,试题难度中等,该类试题综合性强,难易适中,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力;该类试题主要是以常见仪器的选用、实验基本操作为中心,重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 3.36g | C. | 4.2g | D. | 5.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的键线式可写作
的键线式可写作 ,某有机物的键线式为
,某有机物的键线式为 ,其名称正确的是( )
,其名称正确的是( )| A. | 5-乙基-2-己烯 | B. | 2-甲基庚烯 | C. | 3-甲基-5-庚烯 | D. | 5-甲基-2-庚烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫酸铜溶液中加入氢氧化钡溶液Cu2++SO42-+Ba2++2OH-═BaSO4↓+Cu(OH)2↓ | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| C. | 向碳酸氢钠溶液中加入盐酸溶液:HCO3-+H+═CO2↑+H2O | |
| D. | 用氨水和氯化铝反应制备氢氧化铝沉淀:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和  ②
② 和
和 
 与
与
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com