
分析 (1)等体积混合0.1mol•L-1的盐酸和0.06mol•L-1的Ba(OH)2溶液混合,发生H++OH-=H2O,反应后OH-过量,假设体积都为1L,则混合体积为2L,计算c(OH-),可计算pH;
(2)pH=13的强碱溶液中c(OH-)=0.1mol/L,pH=2的强酸溶液中c(H+)=0.01mol/L,混合液的pH=11,则混合溶液中c(OH-)=10-3mol/L=$\frac{c(O{H}^{-})V(碱)-c({H}^{+})C(酸)}{V(碱)+V(酸)}$,据此计算酸碱体积之比.
解答 解:(1)假设体积都为1L,则1L0.1mol•L-1的盐酸中n(H+)=0.1mol,1L0.06mol•L-1的Ba(OH)2溶液n(OH-)=0.12mol,
等体积混合发生H++OH-=H2O,
反应后c(OH-)=$\frac{0.12mol-0.1mol}{2L}$=0.01mol/L,则pH=12,
答:该溶液的pH是12;
(2)pH=13的强碱溶液中c(OH-)=0.1mol/L,pH=2的强酸溶液中c(H+)=0.01mol/L,混合液的pH=11,
则混合溶液中c(OH-)=10-3mol/L=$\frac{c(O{H}^{-})V(碱)-c({H}^{+})C(酸)}{V(碱)+V(酸)}$=$\frac{0.1×V(碱)-0.01×V(酸)}{V(碱)+V(酸)}$,
解得:V(碱):V(酸)=1:9,
答:强碱溶液与强酸溶液的体积比为1:9.
点评 本题考查溶液pH的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用,把握反应的关系,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.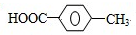 ,②化合物S可在一定条件下发生反应生成高聚物,写出该聚合反应方程式:
,②化合物S可在一定条件下发生反应生成高聚物,写出该聚合反应方程式: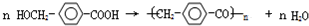 .
. 和
和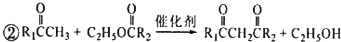 ,M的结构简式为
,M的结构简式为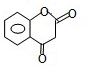 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol丙烯中含有共价键的数目为0.6NA | |
| B. | 0.1mo Cl2全部溶于水后转移电子的数目为0.1NA | |
| C. | 标准状况下,2.24LSO3中含有氧原子的数目为0.3NA | |
| D. | 9.2g由乙醇和二甲醚(CH3OCH3)组成的混合物中含有氧原子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
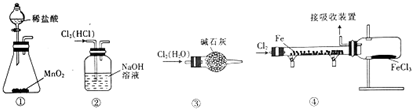
| A. | 用装置①制取氯气 | B. | 用装置②除去Cl2中的HCl | ||
| C. | 用装置③干燥氯气 | D. | 用装置④制取并收集FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
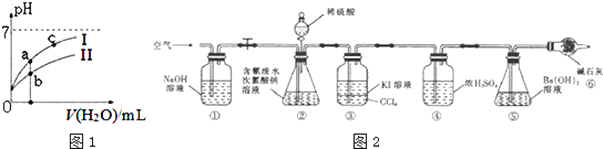
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
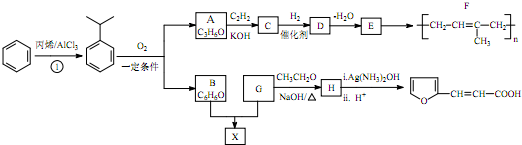
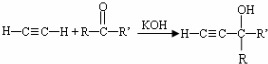
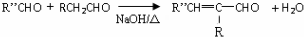 (-R、-R′、-R″表示可能相同或可能不同的原子或原子团)
(-R、-R′、-R″表示可能相同或可能不同的原子或原子团)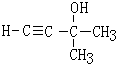 .
.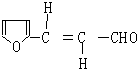 ,H的同分异构体中属于芳香族化合物的共有5种.
,H的同分异构体中属于芳香族化合物的共有5种.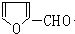 +CH3CHO$→_{△}^{NaOH}$
+CH3CHO$→_{△}^{NaOH}$ +H2O.
+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25℃时,pH=4.5的硫酸溶液中c(H+) 是pH=5.5的磷酸中c(H+)的10倍 | |
| B. | 因为合金在潮湿的空气中易形成原电池,所以合金的耐腐蚀性都较差 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 常温下,2NO(g)+O2(g)?2NO2(g)能够自发进行,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L 水中所含原子总数为3NA | |
| B. | 1molNa2O2与足量CO2反应转移的电子数2NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com