
分析 (1)根据微粒中元素的化合价进行判断,若元素处于最高价,该粒子只有氧化性,若化合价处于最低价,只具有还原性,若处于中间价态,既具有氧化性,也具有还原性;
(2)在Cl2+2NaOH=NaCl+NaClO+H2O反应中,氯气中氯元素化合价由0价降低为-1价,氯气是氧化剂,氯气中氯元素化合价由0价升高为+1价,氯气又是还原剂,根据产物可知起氧化剂与还原剂的氯气各占一半;3NaClO═2NaCl+NaClO2为歧化反应,3molNaClO转移2mol电子,据此解答;
(3)根据Na2FeO4中化合价的代数和为0计算铁元素的化合价,根据Na2FeO4转化为Fe3+结合化合价变化判断.
解答 解:(1)Cl-、ClO-、ClO${\;}_{2}^{-}$、ClO${\;}_{3}^{-}$、ClO${\;}_{4}^{-}$中,从元素化合价的角度分析,化合价处于最高价,粒子只有氧化性,满足该条件的粒子为:ClO${\;}_{4}^{-}$;粒子中元素化合价处于中间价态,既有氧化性又有还原性的是:ClO-、ClO${\;}_{2}^{-}$、ClO${\;}_{3}^{-}$共3种,故答案为:ClO${\;}_{4}^{-}$;3;
(2)在Cl2+2NaOH=NaCl+NaClO+H2O反应中,氯气中氯元素化合价由0价降低为-1价,氯气是氧化剂;氯气中氯元素化合价由0价升高为+1价,氯气又是还原剂,根据产物中氯原子化合价变化,可知起氧化剂与还原剂的氯气各占一半,所以反应的氧化剂与还原剂之比为1:1;
3NaClO═2NaCl+NaClO2为歧化反应,3molNaClO转移2mol电子,故每消耗1molNaClO,转移电子的数目为$\frac{2}{3}$mol电子;
故答案为:1:1;$\frac{2}{3}$mol;
(3)因为Na2FeO4中化合价的代数和为0,所以Na2FeO4中铁元素的化合价为+6,又Na2FeO4转化为Fe3+,铁元素化合价降低,则它表现出的性质是氧化性,故答案为:+6;氧化性.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及其应用的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 滴加KI溶液时,当有2molI-参加反应,则生成1mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,体现了SO2的氧化性 | |
| C. | 通入SO2时,SO2与I2反应,I2作还原剂,H2SO4是氧化产物 | |
| D. | 上述实验条件下,物质的还原性:Cu+>I->SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | 30 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此合金的熔点、硬度比镁和铝的熔点、硬度都高 | |
| B. | 此合金能全部溶解于稀盐酸中 | |
| C. | 此合金能全部溶解于氢氧化钠溶液中 | |
| D. | 比合金不能全部溶解于过量Fe2Cl3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2AsO3-+OH(用离子方程式表示),该溶液中c(H2AsO3-)>c(AsO33-)(填”>”、“<”或“=”).
H2AsO3-+OH(用离子方程式表示),该溶液中c(H2AsO3-)>c(AsO33-)(填”>”、“<”或“=”).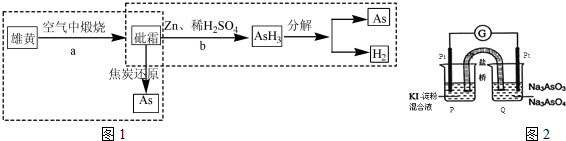
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe3+具有氧化性 | 取少量0.1mol/L FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液. | 加入铁粉后,溶液颜色变为浅绿色.加入KSCN溶液后,溶液不变色. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A-)<c(K+) | B. | c(H+)=c(OH-)<c(K+)<c(A-) | ||
| C. | V总≥20mL | D. | V总≤20mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com