
【题目】磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05mg·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
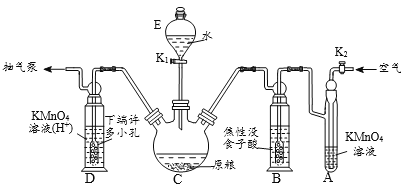
【操作流程】安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
【实验装置】C中盛100 g原粮,D中盛有 20.00 mL 1.12×10-4 mol L-1KMnO4溶(H2SO4酸化)。
请回答下列问题:
(1)仪器C的名称是_________;原粮最好先打成粉末,其原因是_____________。
(2)磷化钙与水反应有化学方程式为_____________________________________;检查整套装置气密性良好的方法是_______________________________________。
(3)A中盛装KMnO4溶液的作用是除去空气中的还原性气体;B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止___________;通入空气的作用是____________。
(4)D中PH3被氧化成磷酸,所发生反应的离子方程式为_________________________。
(5)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5mol L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗标Na2SO3准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为______mg kg-1,该原粮质量________(填“合格”或“不合格”)。
【答案】 三颈烧瓶 使原粮中磷化物与水充分反应 Ca3P2+6H2O===3Ca(OH)2+2PH3↑ 关闭K1、打开K2用抽气泵缓慢抽气,若观察到A、B、D各装置中有气泡产生则气密性良好 [或在D左边用橡胶管和止水夹封闭、关闭K2用压差法;或关闭分液漏斗旋塞后对C加热法] 氧化装置C中生成的PH3 吹出PH3,使其全部被酸性KMnO4溶液吸收 5PH3+8MnO4-+24H+==5H3PO4+8Mn2++12H2O 0.0085 合格
【解析】(1)仪器C的名称是三颈烧瓶;原粮打成粉末可以增大接触面积,有利于反应充分进行;
(2)依据题干信息磷化钙与水反应生成氢氧化钙和磷化氢;利用装置特征关闭K1、打开K2用抽气泵缓慢抽气,若观察到A、B、D各装置中有气泡产生则气密性良好 ;或在D左边用橡胶管和止水夹封闭、关闭K2用压差法;或关闭分液漏斗旋塞后对C加热法; 故答案为:Ca3P2+6H2O===3Ca(OH)2+2PH3↑;关闭K1、打开K2用抽气泵缓慢抽气,若观察到A、B、D各装置中有气泡产生则气密性良好 [或在D左边用橡胶管和止水夹封闭、关闭K2用压差法;或关闭分液漏斗旋塞后对C加热法]
(3)依据装置图中装置中的试剂选择分析判断,高锰酸钾溶液是强氧化剂可以吸收空气中的还原性气体;焦性没食子酸先和碱反应,再和氧气反应可以吸收氧气;若不吸收氧气,PH3会在氧气中燃烧,准确测定PH3的含量,需要用高锰酸钾溶液全部吸收,避免产生较大误差,通入空气的作用是保证PH3全部被吸收的措施。故答案为:氧化装置C中生成的PH3;吹出PH3,使其全部被酸性KMnO4溶液吸收。
(4)PH3被酸性高锰酸钾氧化成磷酸,高锰酸钾被还原为锰离子,结合电子守恒和电荷守恒、原子守恒配平书写得到离子方程式为:5PH3+8MnO4-+24H+==5H3PO4+8Mn2++12H2O
(5)收集E中吸收液,加水稀释至250mL,取25.00mL于锥形瓶中用浓度为5×105mol/L Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL;依据滴定反应:2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O;2KMnO45Na2SO3;未反应的高锰酸钾物质的量=![]() ;与PH3反应的高锰酸钾物质的量
;与PH3反应的高锰酸钾物质的量![]() ;根据反应5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O;得到定量关系为:5PH38KMnO4;计算得到PH3物质的量
;根据反应5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O;得到定量关系为:5PH38KMnO4;计算得到PH3物质的量![]() ;则PH3的质量分数
;则PH3的质量分数![]() ,当粮食中磷化物(以PH3计)的含量不超过0.05mgkg1时,粮食质量合格,所以该原粮质量合格。
,当粮食中磷化物(以PH3计)的含量不超过0.05mgkg1时,粮食质量合格,所以该原粮质量合格。


科目:高中化学 来源: 题型:
【题目】中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),下列相关判断正确的是( )
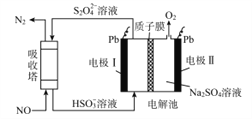
A. 吸收塔中的反应为2NO+2S2O32-+H2O=N2+4HSO3-
B. 电解池中质子从电极I向电极Ⅱ作定向移动
C. 电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2
D. 每处理1 mol NO电解池质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.烧碱、液态氧、碘酒
B.生石灰、白磷、熟石灰
C.干冰、铁、氯化氢
D.空气、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
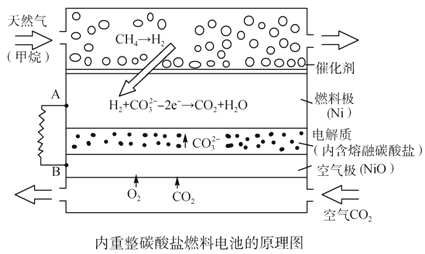
A. 以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B. 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O
C. 该电池使用过程中需补充Li2CO3和K2CO3
D. 空气极发生的电极反应式为O2+4e-+2CO2===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
(1)若D为硫酸,则B的化学式是______。
(2)若D为硝酸,则C的颜色为______;C转化为B的反应方程式为____________。
(3)欲分离硫酸和硝酸的混合溶液,可采取的分离方法是______。
(4)有一硫酸和硝酸的混合溶液,取出100mL加入足量BaCl2溶液,过滤,洗涤,烘干后得到93.2g沉淀:滤液与4mol/LNaOH溶液反应,消耗400mLNaOH溶液时恰好完全中和。计算可得:
①混合溶液中硝酸的物质的量浓度为______;
②另取100mL原混合溶液稀释至200mL,成为稀酸,加入44.8g铜粉共热,收集到的气体在标准状况下的体积为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示。
X | Y | ||
Q | Z |
这4种元素的原子最外层电子数之和为22。据此回答下列问题:
(1)Q的单质常用于制作半导体,则Q在元素周期表中的位置为________。
(2)X的最低价氢化物的结构式为__________。
(3)Q、X、Z的最高价含氧酸中,酸性最强的是____________。
(4)X、Y和氢3种元素形成的化合物中既含有离子键又含有共价键的是________(任写一种的化学式)。
(5)X的简单氢化物与Y的单质在催化加热条件下反应生成两种氧化物,该反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是
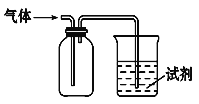
选项 | 试剂 | 现象 | 结论 |
A | 溴水 | 溶液褪色 | SO2有氧化性 |
B | H2S溶液 | 淡黄色沉淀 | SO2有氧化性 |
C | NaOH溶液 | 无明显现象 | SO2与NaOH溶液不反应 |
D | 紫色石蕊试液 | 溶液变红色后不褪色 | SO2有酸性、没有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙醇制取环乙二酸乙二酯时,最简便的流程需要下列哪些反应,其正确的顺序是:①取代;②加成;③氧化;④还原;⑤消去;⑥酯化;⑦中和
A. ①②③⑤⑦ B. ⑤②①③⑥ C. ⑤②①④⑦ D. ①②⑤③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制0.5mol/L硫酸溶液500mL,需要用10mol/L的硫酸溶液的体积是( )
A.50mlB.75mlC.100mLD.25mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com