
| A. | HCl | B. | H2SO4 | C. | NaCl | D. | Na2SO4 |
分析 用石墨作电极电解下列电解质溶液,
A.如果电解质是HCl,阴极上H+放电,阳极上是OH-放电,实质上是电解H2O;
B.电解H2SO4溶液,阴极H+放电,阳极上是OH-放电,实质上是电解H2O
C.电解NaCl溶液,阴极上H2O得电子生成H2和OH-,阳极上Cl-放电生成Cl2;
D.电解Na2SO4溶液,阴极上H+放电,阳极上是OH-放电,实质上是电解H2O.
解答 解:用石墨作电极电解下列电解质溶液,
A.如果电解质是HCl,阴极上H+放电,阳极上是OH-放电,实质上是电解H2O,溶质的物质的量不变,但溶液体积减小,导致c(HCl)浓度增大,pH减小,故A错误;
B.电解H2SO4溶液,阴极H+放电,阳极上是OH-放电,实质上是电解H2O,溶质的物质的量不变,但溶液体积减小,导致c(H2SO4)浓度增大,pH减小,故B错误;
C.电解NaCl溶液,阴极上H2O得电子生成H2和OH-,阳极上Cl-放电生成Cl2,有NaOH生成,导致溶液pH增大,故C正确;
D.电解Na2SO4溶液,阴极上H+放电,阳极上是OH-放电,实质上是电解H2O,溶质的物质的量不变,但溶液体积减小,导致c(Na2SO4)浓度增大,硫酸钠是强酸强碱盐其溶液呈中性,所以电解后溶液仍然呈中性,故D错误;
故选C.
点评 本题考查电解原理,为高频考点,明确离子放电顺序是解本题关键,知道电解后溶液中溶质及其浓度变化即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
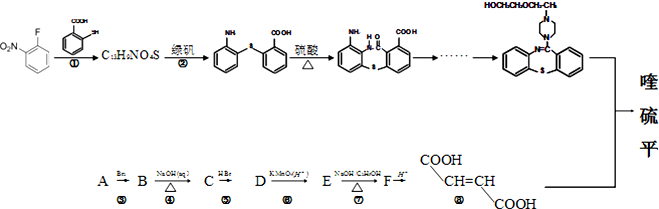
 写出以甲苯为原料制备
写出以甲苯为原料制备 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
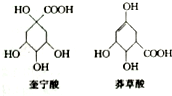 奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )| A. | 奎宁酸的相对分子质量比莽草酸的大18 | |
| B. | 可用高锰酸钾溶液鉴别奎宁酸和莽草酸 | |
| C. | 等物质的量的奎宁酸和莽草酸分别与足量Na反应,同温同压下产生H2的体积比为5:4 | |
| D. | 等物质的量的两种分别与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(A)=2.0mol/(L•s) | B. | V(B)=1.2mol/(L•s) | C. | V(C)=3.2mol/(L•s) | D. | V(D)=4.0 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | R一定有4个电子层 | |
| B. | R原子的最外层电子数一定为6 | |
| C. | R的气态氢化物比电子层数相同的其他非金属元素的气态氢化物稳定 | |
| D. | R气态氢化物化学式为H2R |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
下列溶液中物质的量浓度为1mol/L的是
A.将40gNaOH固体溶解于1L水中
B.将22.4L氯化氢气体溶于水配成1L溶液
C.将1L 10 mol/L的浓盐酸与9L水混合
D.将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、K+、SO42-、Cl- | ||
| C. | Ba2+、Mg2+、SO42-、NO3- | D. | Fe2+、K+、NO3-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com