
| A. | 碳 | B. | 氧 | C. | 硅 | D. | 硫 |
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项[来 | 实验 | 现象 | 结论 |
| A | 常温下,等量等表面积的Al片分别和等体积稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
| B | FeCl3溶液用于刻蚀铜制印刷电路板 | 溶液变蓝 | 氧化性:Cu2+>Fe2+ |
| C | 向FeCl2溶液中加入足量Na2O2粉末 | 出现红褐色沉淀和无色气体 | FeCl2溶液部分变质 |
| D | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的蔗糖溶液 | B. | 0.1mol/L的CaCl2溶液 | ||
| C. | 0.2mol/L的NaCl溶液 | D. | 0.1mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、SiO2的晶体结构类型不同 | |
| B. | 加热硅、硫晶体使之熔化,克服的作用力不同 | |
| C. | HCl、NaCl溶于水,破坏的化学键类型相同 | |
| D. | NaOH、NH4Cl晶体中既有离子键又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  操作I导致配制溶液的物质的量浓度偏小 | |
| B. |  用装置II干燥氨气 | |
| C. |  实验Ⅲ可观察铁钉的吸氧腐蚀 | |
| D. |  实验Ⅳ记录的读数为12.20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

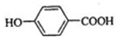 ;
; ,该反应类型为取代反应;
,该反应类型为取代反应; (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com