
 2F2+ 2H2O ="==" 4 HF + O2 5分
2F2+ 2H2O ="==" 4 HF + O2 5分
 ;单质氟能和水反应生成氧气,反应的化学方程式是2F2+ 2H2O ="==" 4 HF + O2。
;单质氟能和水反应生成氧气,反应的化学方程式是2F2+ 2H2O ="==" 4 HF + O2。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案科目:高中化学 来源:不详 题型:单选题
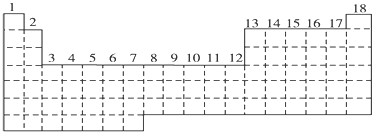
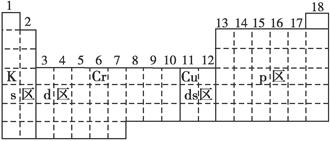
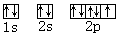
| A.各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7 |
| B.各能层的能级都是从s能级开始至f能级结束 |
| C.各能层含有的能级数为n-1 |
| D.各能层含有的电子数为2n2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素代号 | I1 | I2 | I3 | I4 |
| E | 500 | 4600 | 6900 | 9500 |
| F | 740 | 1500 | 7700 | 10500 |
| H | 580 | 1800 | 2700 | 11600 |
| I | 420 | 3100 | 4400 | 5900 |
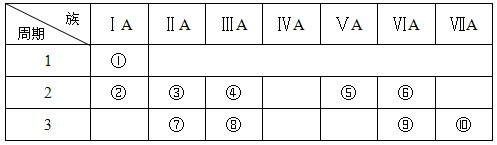
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子含未成对电子最多的第二周期元素 | B.原子最外层电子排布为2s22p4的元素 |
| C.位于周期表中第三周期ⅢA族的元素 | D.原子最外层电子排布为3s23p3的元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| a | | b | |||||||||||||||
| | | | | | | | | | | | | | c | d | | | |
| e | f | g | h | | | i | | ||||||||||
| | | | | | | | | j | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
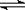 NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____ __ (填序号) 。
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____ __ (填序号) 。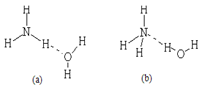
| | 锂 | X | Y |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | | 9550 | 11600 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.16O和18O是同一种核素 | B. 1H218O的摩尔质量为20 |
| C.34S和15N核内的中子数相差9 | D.2H+核外电子数为0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
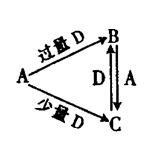
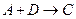 的热化学方程式:
的热化学方程式: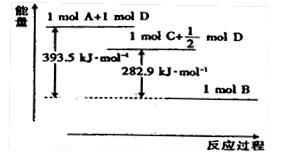
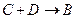 的
的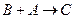 的离子方程式为_________
的离子方程式为_________ _______________________。
_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com