
(1)①根据下列图示,写出反应的热化学方程式___________________________。

②根据如图所示情况,判断下列说法中正确的是________。

A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其反应热值小于41 kJ·mol-1
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是________________________________________。
(3)如图是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为_________________________________。

a、b两条曲线产生区别的原因很可能是_________________________________。
(1)①CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ·mol-1 ②B
(2)S(s)+O2(g)=SO2(g) ΔH=-296.8 kJ·mol-1
(3)N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1
2NH3(g) ΔH=-92 kJ·mol-1
a不使用催化剂,b使用了催化剂
【解析】 (1)②以图示形式将反应CO2(g)+H2(g)=CO(g)+H2O(g)的质变与能变呈现出来,并要求判断反应类型及ΔH情况,根据所给图示可知,A选项将反应的反应物与生成物弄反了,故不对,生成物的能量比反应物的能量高,故该反应为吸热反应,B选项正确,则C选项错误;D选项未限定H2O的物质的量,故不对。
(3)b反应中使用催化剂,可以降低反应的活化能,但反应的热效应不会改变。


科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:填空题
能源的开发利用与人类社会的可持续发展息息相关。
Ⅰ.已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)
ΔH1=a kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH3=c kJ·mol-1
则C的燃烧热ΔH=________ kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是________(填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:____________________________________________________________。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为p0,反应过程中压强用p表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为p0,反应过程中压强用p表示,反应过程中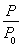 与时间t的关系如图所示。
与时间t的关系如图所示。

请回答下列问题:
①反应达平衡的标志是(填字母代号)________。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②0~2 min内,以c(N2)变化表示的平均反应速率为________。
③欲提高N2的转化率,可采取的措施有________。
A.向体系中按体积比1∶1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入氦气使压强增大
E.加入一定量的N2
(3)25 ℃时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(CO32-)=0.2 mol·L-1,如果加入等体积的Na2SO4溶液,若要产生BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第8讲电化学练习卷(解析版) 题型:选择题
如图所示,?为直流电源,?为浸透饱和氯化钠溶液和酚酞试液的滤纸,?为电镀槽。接通电路(未闭合K)后发现?上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是( )。

A.b为直流电源的负极
B.f极为阴极,发生还原反应
C.e极材料为铁片,f极材料为铜片
D.可选用CuSO4溶液或CuCl2溶液作电镀液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:填空题
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g)??B(g)+C(g) ΔH=+85.1 kJ·mol-1
ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为____________________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________。平衡时A的转化率为__________,列式并计算反应的平衡常数K__________________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=________ mol,n(A)=________ mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
反应时间t/h | 0 | 4 | 8 | 16 |
c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:选择题
利用醋酸二氨合铜[Cu(NH3)2Ac]溶液吸收CO,能达到保护环境和能源再利用的目的,反应方程式为Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
[Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
温度/℃ | 15 | 50 | 100 |
化学平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )。
A.上述正反应为吸热反应
B.15 ℃时,反应[Cu(NH3)]Ac·CO Cu(NH3)2Ac+CO+NH3的平衡常数为0.5
Cu(NH3)2Ac+CO+NH3的平衡常数为0.5
C.保持其他条件不变,减小压强,CO的转化率减小
D.醋酸二氨合铜溶液的浓度大小对CO的吸收没有影响
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第5讲化学反应与能量练习卷(解析版) 题型:选择题
100 g炭粉燃烧所得气体中,CO占 、CO2占
、CO2占 ,且C(s)+
,且C(s)+ O2(g)=CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+
O2(g)=CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+ O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1,与这些炭粉完全燃烧相比损失的热量是 ( )。
O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1,与这些炭粉完全燃烧相比损失的热量是 ( )。
A.784.92 kJ B.2 489.44 kJ C.1 569.83 kJ D.3 274.3 kJ
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第4讲物质结构元素周期律练习卷(解析版) 题型:填空题
A、B、C、D、E为五种原子序数依次增大的短周期主族元素。已知B的最外层电子数与核外电子总数之比为3∶4;D的最外层电子数与次外层电子数之比为3∶4,E-、C+、A+的半径逐渐减小;常温下化合物AE为气体。
请回答下列问题:
(1)D、E的最高价氧化物对应水化物酸性较强的是________(写化学式)。
(2)用惰性电极电解化合物CE的饱和溶液,当电路中有0.2 mol电子通过时两极产生的气体在标准状况下的体积共________ L。
(3)A与B、A与D均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:_______________________________。
(4)化合物乙、丙均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,乙溶液中水的电离程度比纯水的小。则化合物乙中的化学键类型为________;若丙为常见家用消毒剂的主要成分,则丙的化学式是________。
(5)均由A、B、C、D四种元素组成的两种盐发生反应的离子方程式是______________________________________________;其中一种是强酸对应的酸式盐,写出向Ba(OH)2溶液中逐滴加入该盐溶液至中性发生反应的离子方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第3讲两种重要的化学反应练习卷(解析版) 题型:选择题
LiAlH4是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈反应释放出氢气,LiAlH4在125 ℃分解为LiH、H2和Al。下列叙述错误的是( )。
A.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂
B.LiAlH4与D2O反应,所得氢气的摩尔质量为4 g·mol-1
C.1 mol LiAlH4在125 ℃完全分解,转移3 mol电子
D.LiAlH4与水反应生成三种物质时,化学方程式可表示为:LiAlH4+4H2O=Al(OH)3+LiOH+4H2↑
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第13讲实验方案设计与评价练习卷(解析版) 题型:填空题
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:

(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率;②________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42—,该反应的离子方程式为________________________________________________________________________。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入稀盐酸、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应的化学方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62—
Sn2++4Cl-+2HgCl2=SnCl62—+Hg2Cl2↓
6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量________(填“偏高”、“偏低”或“不变”,下同);
②若不加HgCl2,则测定的Fe3+量________。
(4)①可选用________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是________________________________________________________________________(用离子方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀硝酸、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。
请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:________________________________________________________;
b.沉淀:__________________________________________________________;
c.分离,洗涤;
d.烘干,研磨。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com