
����Ŀ��1887�꣬Ӣ���˺���ɭ����������ĸɵ�أ����ɵ���Ѿ���չ��Ϊһ���Ӵ�ļ��壬�����100���֡�Ӧ�ù㷺����Zn��MnO2�ɵ�أ���������Һ��ZnCl2��NH4Cl�����Һ����ع���һ��ʱ�����ڴ���7�����ʣ�NH3��Mn2O3��ZnCl2��MnO2��NH4Cl��Zn��H2O����ش���������
��1���õ�صĸ���������__����ع���ʱ����������__��������������������������ͬ�����ŵ�ʱNH4+��___�ƶ���
��2����������ԭ��Ӧ�Ļ�ѧ����ʽΪ__��������ԭ��Ӧ��������__����������Ԫ����__������17.4g���������뷴Ӧ�������ת����ĿΪ__NA��NA��ʾ�����ӵ�������ֵ����
��3����ͨп�̵�ص�ȱ���ǵ���С���ŵ��������Ϊ����ŵ�������ɰѸ���пƬ��Ϊп�ۣ���������___��
��4����ZnCl2��NH4Cl�����Һ�к�������Cu2+�������ij�缫�ĸ�ʴ������Ҫԭ����__������ȥCu2+�����ѡ�������Լ��е�__������ţ���
a.NaOH b.Zn c.Fe d.NH3��H2O
���𰸡�Zn����п�� ���� ���� Zn+2MnO2+2NH4Cl=ZnCl2+Mn2O3+H2O+2NH3�� MnO2 Zn 0.2 ʹ��Ӧ���������߷ŵ�Ч�� п���û�������ͭ����ͭпԭ��ض��ӿ�п�ĸ�ʴ b
��������
��ظ����ǻ��ý�������������Ӧ�������ɵ�ظ���������������Һ�����������ƶ����������������ƶ������ݵ缫��Ӧ������صļ��㣬�ݴ˽��
��1����ظ����ǻ��ý�������������Ӧ�����Ը���������п�������ɸ��������������ŵ�ʱ�������������ƶ���
��Ϊ��п��������������
��2��пʧȥ���ӣ�����������Ӧ����п���ӣ����������̵õ��ӣ�������ԭ��Ӧ�������������̣����ݵ�ʧ�����غ���ƽ�ã�2MnO2+2NH4Cl+Zn=NH3��+Mn2O3+ZnCl2+H2O�����������е�����+4�۱��+3�ۣ�������ԭ��Ӧ����������17.4g MnO2�����ʵ���= ![]() =0.2mol��������+4�۱��+3�ۣ�1mol MnO2ת��1mol���ӣ���0.2mol MnO2ת��0.2mol���ӡ�
=0.2mol��������+4�۱��+3�ۣ�1mol MnO2ת��1mol���ӣ���0.2mol MnO2ת��0.2mol���ӡ�
����2MnO2+2NH4Cl+Zn=NH3��+Mn2O3+ZnCl2+H2O��MnO2��Zn��0.2��
��3��пƬ��Ϊп�ۣ�������������Ӧ��������
��Ϊ��ʹ��Ӧ���������߷ŵ�Ч�ʡ�
��4���绯ѧ��ʴ�Ȼ�ѧ��ʴ���죬п���û�������ͭ����ͭпԭ��ض��ӿ�п�ĸ�ʴ������ʱ���ܳ�ȥ�����ֲ��������µ��������ӣ�����a���d�������Һ�е�Zn2+��Ӧ��c�������������Fe2+������ѡb�
��Ϊ��п���û�������ͭ����ͭпԭ��ض��ӿ�п�ĸ�ʴ��b��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����һ���¶��£������з�Ӧ������Fe2O3(s)��3CO(g) 2Fe(s)��3CO2(g)���÷�Ӧ��ƽ�ⳣ������ʽK��________��
��2��������FeCl3��Һʱ����������Ũ���ᣬ��Ŀ���ǣ�_____________�����ϼ���FeCl3��Һ��������ˮ�ֲ����չ��壬���õ���������________��
��3����֪��Fe2O3(s)��![]() C(s)=
C(s)=![]() CO2(g)��2Fe(s) ��H����234.1 kJ/mol
CO2(g)��2Fe(s) ��H����234.1 kJ/mol
C(s)��O2(g)===CO2(g)�� ��H����393.5 kJ/mol
��2Fe(s)��![]() O2(g)===Fe2O3(s)�Ħ�H��____________________��
O2(g)===Fe2O3(s)�Ħ�H��____________________��
��4��Fe(OH)2�ڿ����ж�ʱ���ڿɱ�����ΪFe(OH)3�������ķ�ӦΪ��4Fe(OH)2��O2��2H2O=4Fe(OH)3������˵���д������________(����ĸ)��
A���÷�Ӧ�����Է����еķ�Ӧ
B���÷�Ӧ�������ӵķ�Ӧ
C���÷�Ӧ�ǻ��Ϸ�Ӧ
D���÷�Ӧ��������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��ݷ�Ӧԭ����Ƶ�Ӧ�ã�����ȷ���ǣ�������
A.![]() ��H2O
��H2O![]()
![]() ��OH�� ���ȵĴ�����Һ��ϴ����
��OH�� ���ȵĴ�����Һ��ϴ����
B.Al3����3H2O![]() Al(OH)3(����)��3H�� ������ˮ
Al(OH)3(����)��3H�� ������ˮ
C.TiCl4��(x��2)H2O(����)![]() TiO2��xH2O����4HCl�Ʊ�TiO2����
TiO2��xH2O����4HCl�Ʊ�TiO2����
D.SnCl2��H2O![]() Sn(OH)Cl����HCl �����Ȼ�������Һʱ������������
Sn(OH)Cl����HCl �����Ȼ�������Һʱ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ���C2H5OH��ȼ�ϵ����һ�����͵�أ����в������ӣ�H+���ܼ�����200������ʱ���磬����ܷ�ӦΪC2H5OH+3O2=2CO2+3H2O���õ�صĹ���ԭ����ͼ��ʾ������˵����ȷ���ǣ� ��
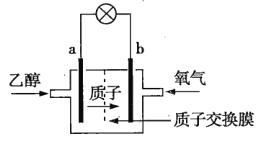
A.ͨ���Ҵ���a�缫������
B..������b�缫�Ϸ���������Ӧ
C.��ع���ʱ���������صĸ���Ǩ��
D.��ع���ʱ��������b���ص�������a��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�ŷ���Ӱ������仯����Ҫ����֮һ���������ѧ�ҿ�����һ����ϵͳ�����ܽ⡱ˮ�еĶ�����̼���Դ����绯ѧ��Ӧ�����ɵ��ܺ��������乤��ԭ����ͼ��ʾ�������й�˵���в���ȷ���ǣ�������
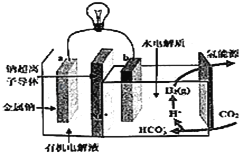
A. ϵͳ����ʱ����ѧ��ת��ɵ���
B. ϵͳ����ʱ��������a���ص�������b��
C. ϵͳ����ʱ��b�������ܻ���������
D. ϵͳ����ʱ��b�����ĵ缫��ӦʽΪ2CO2+2H2O+2e����2HCO3��+H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ƭ��Ҫ�ɷ�ΪKMnO4������������ɱ������ij���̿�(��Ҫ�ɷ���MnO2��������A12O3��SiO2������)�Ʊ�KMnO4������ͼ���£�
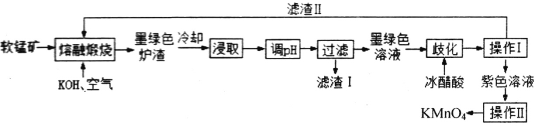
��֪��K2MnO4�������Һ��Ϊī��ɫ����Һ�ʼ������ܷ���������绯��Ӧ��
(1)������I���в�������������____________������������ʱ����__________ʱ��ֹͣ���ȣ���Ȼ��ȴ�����˺ɻ���Ϻ�ɫKMnO4���塣
(2)������ȡҺ����ͨ��CO2��������pH������������������I������I�ijɷ�Ϊ__________��
(3)������������ʱ��MnO2���뷴Ӧ�Ļ�ѧ����ʽΪ_________________________��
(4)���绯��ʱ������������Ŀ����___________________________(�ñ�Ҫ�����ӷ���ʽ�����ֽ���)��
(5)���绯��ʱ���������������������������___________(����ĸ)��
a��Ũ���� b�������� c��ϡ���� d�������
(6)��ȡ�����У���pH���ڲ�����������Mn2+���ڷ�ˮ���������г���H2S��Mn2+ת��ΪMnS��ȥ����0.05mol��L-1Mn2+��ˮ��ͨ��һ����H2S���壬������Һ��pH=a����HS-Ũ��Ϊ1.0��10-4mol��L-1ʱ��Mn2+��ʼ��������a=__________��[��֪��H2S��Ka1=1.3��10-7 Ka2=5.0��10-15��Ksp(MnS)=2.5��10-14]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. �Ȼ�ѧ����ʽ�У���ѧʽǰ��Ļ�ѧ�������ȿɱ�ʾ�������ֿɱ�ʾ���ʵ���
B. ��д�Ȼ�ѧ����ʽʱ������Ҫд����Ӧ�ȵķ��ź���ֵ����Ҫע�������ʵľۼ�״̬
C. �Ȼ�ѧ����ʽ�У����û��ע���¶Ⱥ�ѹǿ�����ʾ�ڱ�״���²�õ�����
D. ���ǻ��Ϸ�Ӧ���Ƿ��ȷ�Ӧ���ֽⷴӦ�������ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������(PPG)��һ�ֿɽ���ľ�����߷��Ӳ��ϣ��ڲ��ϵ����������Է����кܺõ�Ӧ��ǰ����PPG��һ�ֺϳ�·������:
![]()
��֪:
����A����Է�������Ϊ70���˴Ź���������ʾֻ��һ�ֻ�ѧ��������
�ڻ�����BΪ���ȴ�����������C�ķ���ʽΪC5H8
��E��FΪ��Է���������14��ͬϵ�F�Ǹ������ֵ�����
��R1CHO+R2CH2CHO![]()
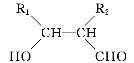
�ش���������:
(1)A�Ľṹ��ʽΪ___________________��
(2)��B����C�Ļ�ѧ����ʽΪ________________________________________��
(3)��E��F����G�ķ�Ӧ����Ϊ_________��G�Ļ�ѧ����Ϊ______________��
(4)D��ͬ���칹������ͬʱ�������������Ĺ���_______________��(���������칹)��
�����뱥��NaHCO3��Һ��Ӧ��������
�ڼ��ܷ���������Ӧ�����ܷ���������Ӧ
���к˴Ź���������ʾΪ3��壬�ҷ������Ϊ6��1��1����_________(д�ṹ��ʽ)��D������ͬ���칹��������һ�ֱ�����������ʾ���ź�(������)��ȫ��ͬ����������__(����)��
a.������ b.���������
c.Ԫ�ط����� d.�˴Ź�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ�Ӻ���p�ܼ���d�ܼ���ԭ�ӹ���ϵ����Ų�Ϊ��ȫ��������������ȫ������ʱ��һ������ȶ�����Ϊ���ع����������������ʵ������Ϊ��������֤�ݵ��ǣ�������
A.��Ԫ�صĵ�һ������С����Ԫ�صĵ�һ������
B.��Ԫ�صĵ�һ�����ܴ�����Ԫ�صĵ�һ������
C.��̬ͭԭ�ӵĺ�������Ų�ʽΪ![]() ������
������![]()
D.ij�ּ���̬̼ԭ�ӵĺ�������Ų�ʽΪ![]() ������
������![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com