
| A、0.5mol?L-1NH4Cl |
| B、0.5mol?L-1醋酸 |
| C、0.5mol?L-1H2SO4 |
| D、0.5mol?L-1Cu(NO3)2 |


科目:高中化学 来源: 题型:
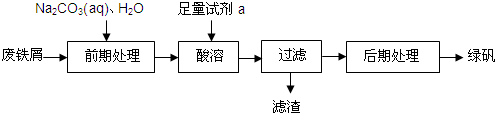
| 温度/ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/ | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4?7H2O | FeSO4?4H2O | FeSO4?H2O | |||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl和KCl |
| B、NaCl和KCl和I2 |
| C、NaCl和KI |
| D、NaBr和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3 mL 2 mol/L的NaCl溶液 |
| B、50 mL 4 mol/L的FeCl3溶液 |
| C、200 mL 1mol/L的HCl溶液 |
| D、50 mL 3 mol/L的BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应△H>0 |
| B、强电解溶液的导电能力一定强于弱电解质溶液的导电能力 |
| C、CH3COOH、Cu(OH)2、BaSO4、NH3都是常见的弱电解质 |
| D、常温下就能发生的化学反应一定是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Cl2+2NaI═2NaCl+I2 | ||||
B、NH4HCO3
| ||||
| C、4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||||
D、Fe2O3+3CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 .B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
.B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>②>③>④ |
| B、②>③>④>① |
| C、②>①>③>④ |
| D、③>①>④>② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com