
分析 加成反应指有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应;先判断该烃结构是否对称,如果对称,只考虑该分子一边的结构和对称线两边相邻碳原子即可;如果不对称,要全部考虑,然后各去掉相邻碳原子上的一个氢原子形成双键.
解答 解:根据烯烃与H2加成反应的原理,推知该烷烃分子中相邻碳原子上均带氢原子的碳原子间是对应烯烃存在碳碳双键的位置.该烷烃的碳链结构为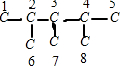 ,1号和5号碳原子关于3号碳原子对称,所以能形成双键位置有:1和2之间(或4和5)(或2和6之间)(或4和8),;2和3之间(或4和3);3和7之间,故该烃共有3种,所以有机物可能的结构简式为CH2=C(CH3)CH(CH3)CH(CH3)2、CH3C(CH3)=C(CH3)CH(CH3)2、[(CH3)2CH]2C=CH2,
,1号和5号碳原子关于3号碳原子对称,所以能形成双键位置有:1和2之间(或4和5)(或2和6之间)(或4和8),;2和3之间(或4和3);3和7之间,故该烃共有3种,所以有机物可能的结构简式为CH2=C(CH3)CH(CH3)CH(CH3)2、CH3C(CH3)=C(CH3)CH(CH3)2、[(CH3)2CH]2C=CH2,
故答案为:CH2=C(CH3)CH(CH3)CH(CH3)2;CH3C(CH3)=C(CH3)CH(CH3)2;[(CH3)2CH]2C=CH2.
点评 本题以加成反应为载体,考查同分异构体的书写,理解加成反应原理是解题的关键,采取逆推法还原C=C双键,注意分析分子结构是否对称,防止重写、漏写.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(OH-)=0.001mol•L-1 | B. | 溶液中c(H+ )=10-11 mol•L-1 | ||
| C. | 由水电离出的c(H+ )=0.1mol•L-1 | D. | c(HCO3-)<c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
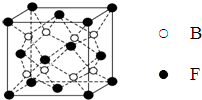 已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)
已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)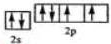 ;H离子电子排布式1s22s22p63s23p6;I位于周期表ds区;D在周期表中的位置第二周期ⅤⅡA族
;H离子电子排布式1s22s22p63s23p6;I位于周期表ds区;D在周期表中的位置第二周期ⅤⅡA族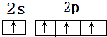 ,不符合能量最低原理原理.
,不符合能量最低原理原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥⑦ | B. | ③④⑥ | C. | ②④⑤⑧ | D. | ①③④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | A | B | R | D |
| 相关信息 | 基态原子核外电子占据3个能级且最高能级上有3个电子 | B的单质是最常见半导体材料 | 位于第四周期ⅠB族 | 是非金属元素,其形成的某种单质是电的良导体,有的分子形状似足球 |
| 键能(kJ/mol) | 熔点(K) | 沸点(K) | |
| BO2 | B-O:452 | 1923 | 2503 |
| DO2 | D=O:615,D-O:348 | 216 | 195 |
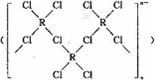 ,研究表明•
,研究表明•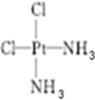 ( AH3配体作为一个整体写).
( AH3配体作为一个整体写).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,写出一个能证明D、E两元素非金属性强弱的事实或反应方程式:Cl2+H2S=2HCl+S↓.
,写出一个能证明D、E两元素非金属性强弱的事实或反应方程式:Cl2+H2S=2HCl+S↓. (或
(或 ),其中含有的化学键为极性键(或极性键、非极性键)(填“极性键”“非极性键”“离子键”).(若有多种可能,只需答出其中一种物质)
),其中含有的化学键为极性键(或极性键、非极性键)(填“极性键”“非极性键”“离子键”).(若有多种可能,只需答出其中一种物质)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |
| Y | Z |
| A. | X、Y、Z可以都是金属 | |
| B. | 原子半径:Z>Y>X | |
| C. | 最高价氧化物对应的水化物酸性:Z>Y>X | |
| D. | 若X、Y、Z可形成  分子,则其中各原子都满足8电子结构 分子,则其中各原子都满足8电子结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com