
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源:2015-2016学年福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列有关油脂的叙述中,错误的是
A.油脂分子结构中三个烃基一定相同
B.可以用纯碱溶液去除油污
C.可以用纯碱区别植物油和柴油
D.工业上可用油脂制造高级脂肪酸
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
常温下,1mol化学键分解成气态原子所需要的能量用E表示.根据表中信息判断下列说法不正确的是
共价键 | H﹣H | F﹣F | H﹣F | H﹣Cl | H﹣I |
E(kJ•mol﹣1) | 436 | 157 | 568 | 432 | 298 |
A.432 kJ•mol﹣1>E(H﹣Br)>298 kJ•mol﹣1
B.表中最稳定的共价键是H﹣F键
C.H2(g)→2H (g)?△H=+436 kJ•mol﹣1
D.H2(g)+F2(g)=2HF(g)?△H=﹣25 kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆四十二中高一下期中化学试卷(解析版) 题型:选择题
短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和.下列说法正确的是( )
A. 元素A所形成的氧化物只有一种
B. 元素B的最高价氧化物对应的水化物为强酸
C. 元素C、D、E的最高价氧化物对应的水化物两两之间可发生反应
D. 氢化物的稳定性:A>B
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆四十二中高一下期中化学试卷(解析版) 题型:选择题
核中中子数为N的R2﹣,质量数为A,则该离子的核外电子数为( )
A. A﹣N﹣2 B. A﹣N+2 C. A+N﹣2 D. A+N+2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆四十二中高一下期中化学试卷(解析版) 题型:选择题
下列元素均位于第ⅦA族,其中非金属性最强的元素是( )
A. F B. Cl C. Br D. I
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南省高一下学期期末考试化学试卷(解析版) 题型:实验题
为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
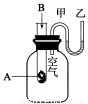
(1)该反应为____________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量____________(填“高”或“低”)。
(3)物质中的化学能通过______转化成______释放出来。
(4)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)若甲烷的燃烧热为890KJ/mol,请写出表示甲烷燃烧热的热化学方程式__________.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下学期期末考试化学试卷(解析版) 题型:推断题
4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
|
| m | n |
x | y |
|
|
回答下列问题:
(1)元素x在周期表中的位置是第________周期、第_________族,其单质可采用电解熔融________的方法制备。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是________,碱性最强的是________。(填水化物的化学式)
(3)气体分子(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省扬州市高二选修下学期期末调研化学试卷(解析版) 题型:填空题
NH3是一种重要的化工原料,也是造成水体富营养化及氮氧化物污染的重要因素之一。
(1)N2和H2以物质的量之比为1∶3在不同温度和压强下发生反应:N2+3H2 2NH3,测得平衡体系中NH3的物质的量分数如图1。
2NH3,测得平衡体系中NH3的物质的量分数如图1。

①为提高原料气的转化率,工业上采取的合理措施有 (填字母)。
a. 采用常温条件
b. 使用适当的催化剂
c. 将原料气加压
d. 将氨液化并不断移出
②图1中所示的平衡体系中NH3的物质的量分数为0.549和0.488时,该反应的平衡常数分别为K1、K2,则K1 K2。(填“>”“<”或“=”)
(2)氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,涉及的相关反应如下:
反应①:NH3+HClO===NH2Cl+H2O
反应②:NH2Cl+HClO===NHCl2+H2O
反应③:2NHCl2+H2O===N2+HClO+3HCl
已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件一定的情况下,改变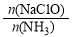 (即NaClO溶液的投入量),溶液中次氯酸钠对氨氮去除率及余氯量 (溶液中+1价氯元素的含量)的影响如图2所示。
(即NaClO溶液的投入量),溶液中次氯酸钠对氨氮去除率及余氯量 (溶液中+1价氯元素的含量)的影响如图2所示。
①反应中氨氮去除效果最佳的n(NaClO)/n(NH3)值约为 。
②a点之前氨氮去除率较低的原因为 。
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图3。
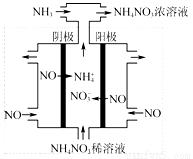
①电解过程(虚线内)发生反应的离子方程式为 。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com