
| 步骤 | 操作 | 现象 |
| (1) | 用pH试纸检验 | 溶液的pH大于7 |
| (2) | 另取少量溶液滴加过量氨水,再通入CCl4振荡,静置 | 上层无色,下层呈橙红色 |
| (3) | 取(2)的上层溶液,加入过量Ba(SO4)2溶液和稀硝酸,过滤 | 有白色沉淀产生 |
| (4) | 向(3)的滤液中加入过量AgNO3溶液和稀硝酸 | 有白色沉淀产生 |
| A. | 肯定含有的离子是Na+、Br-、SO32- | B. | 肯定没有的离子是Ba2+、SO42- | ||
| C. | 不能确定的离子是Na+ | D. | 不能确定的离子是Cl-、SO32- |
分析 (1)取少量溶液滴加几滴石蕊试液,溶液变蓝,说明溶液呈碱性,离子组中没有OH-离子,说明应含有SO32-离子,水解呈碱性,SO32-离子和Ba2+离子生成BaSO3沉淀,不能大量共存,则一定没有Ba2+离子,根据溶液电中性,溶液中一定含有Na+离子;
(2)另取少量溶液滴加过量氯水,再加入CCl4振荡,静置,上层无色,下层呈橙红色,说明溶液中含有Br-离子;
(3)取(2)上层溶液,加入过量Ba(NO3)2溶液和稀HNO3,过滤,有白色沉淀产生,生成的沉淀为BaSO4,但不能说明溶液中含有SO42-离子,也可能是SO32-氧化生成;
(4)向(3)的滤液中加入过量AgNO3溶液和稀HNO3,有白色沉淀产生,该沉淀为AgCl,但不能说明溶液中含有Cl-离子,因第(2)步操作中引入Cl-离子.
解答 解:A、离子组中没有OH-离子,说明应含有SO32-离子,水解呈碱性,SO32-离子和Ba2+离子生成BaSO3沉淀,不能大量共存,则一定没有Ba2+离子,根据溶液电中性,溶液中一定含有Na+离子,另取少量溶液滴加过量氯水,再加入CCl4振荡,静置,上层无色,下层呈橙红色,说明溶液中含有Br-离子,故A正确;
B、Na+和SO32-离子通过实验(1)可以确定存在,但不能确定溶液中是否含有SO42-离子,故B错误;
C、Na+和SO32-离子通过实验(1)可以确定存在,故C错误;
D、通过实验(1)可说明一定含有SO32-离子,故D错误.
故选A.
点评 本题考查离子的检验及推断,题目难度不大,注意离子的氧化性、还原性等知识,做好此类题目,准确掌握物质的性质及离子的检验方法是做好题目的关键.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cl-、K+、NO3- | B. | CO32-、Na+、Cl-、K+ | ||
| C. | Fe3+、Mg2+、NO3-、Cl- | D. | Na+、Ag+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Cl-、I- | B. | Ca2+、Mg2+、HCO3-、NO3- | ||
| C. | K+、Cu2+、SO42-、Cl- | D. | Ag+、Ba2+、NO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
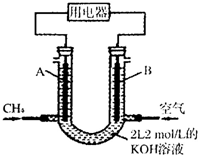 合理利用碳氢化合物以及二氧化碳捕集、存储和转化是当今化学研究的热点问题之一.
合理利用碳氢化合物以及二氧化碳捕集、存储和转化是当今化学研究的热点问题之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CrO2 | B. | CrO3 | C. | Cr2O3 | D. | Cr2O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com