
【题目】碱式次氯酸镁[Mg2ClO(OH)3H2O]微溶于水,不潮解,相对稳定,是一种有开发价值的无机抗菌剂,以菱镁矿(MgCO3,含少量FeCO3)为主要原料制备碱式次氯酸镁的工业流程如下:
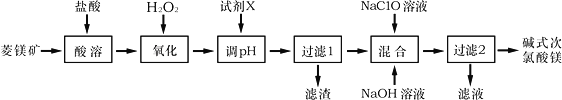
回答下列问题:
(1)菱镁矿“酸溶”时,为了提高溶出率,可采取的措施有________________(写一条)。
(2)H2O2的电子式为___________,它的作用是___________________________________。
(3)“调pH”时加入的试剂X为______________(填化学式)。
(4)“混合”时发生反应的化学方程式为__________________________________________。
“混合”时NaOH溶液需最后加入且不能过量,其原因是__________________________。
(5)在酸性溶液中碱式次氯酸镁具有杀菌、漂白作用的原因是_____________(用离子方程式表示)。
(6)如果以单位质量的消毒剂所得到的电子数来表示消毒效率,碱式次氯酸镁的消毒效率是Cl2的消毒效率的_______倍(计算结果保留两位小数)。
【答案】 粉碎菱镁矿或增大盐酸浓度等 ![]() 将Fe2+氧化为Fe3+ MgO [Mg(OH)2 、MgCO3或Mg(OH)2CO3] NaClO+2MgCl2+3NaOH+H2O=Mg2ClO(OH)3H2O↓+4NaCl 防止生成Mg(OH)2沉淀 Mg2ClO(OH)3H2O+4H+ =2Mg2++HClO+4H2O (或Mg2ClO(OH)3+4H+ =2Mg2++HClO+3H2O) (2分) 0.42
将Fe2+氧化为Fe3+ MgO [Mg(OH)2 、MgCO3或Mg(OH)2CO3] NaClO+2MgCl2+3NaOH+H2O=Mg2ClO(OH)3H2O↓+4NaCl 防止生成Mg(OH)2沉淀 Mg2ClO(OH)3H2O+4H+ =2Mg2++HClO+4H2O (或Mg2ClO(OH)3+4H+ =2Mg2++HClO+3H2O) (2分) 0.42
【解析】(1)菱镁矿“酸溶”时,可通过粉碎菱镁矿、增大盐酸浓度或加热、搅拌等措施溶出率;
(2)H2O2是共价化合物,其电子式为![]() ,滴中过氧化氢的目的是为了将Fe2+氧化为Fe3+;
,滴中过氧化氢的目的是为了将Fe2+氧化为Fe3+;
(3)添加试剂X既能与H+反应,同时不引入杂质,则可选用MgO [Mg(OH)2 、MgCO3或Mg(OH)2CO3];
(4)向MgCl2溶液中滴加NaOH、NaClO的混合溶液,生成Mg2ClO(OH)3H2O,发生反应的化学方程式为NaClO+2MgCl2+3NaOH+H2O=Mg2ClO(OH)3H2O↓+4NaCl;开始加入氢氧化钠或氢氧化钠过量,会生成Mg(OH)2沉淀,故混合时NaOH溶液需最后加入且不能过量;
(5)碱式次氯酸镁在酸性溶液中会生成HClO,能杀菌、漂白作用,发生反应的离子方程式为Mg2ClO(OH)3H2O+4H+ =2Mg2++HClO+4H2O;
(6)假设质量都是mg,Mg2ClO(OH)3H2O→Cl-得2个电子,Cl2→2Cl-得2个电子,所以Mg2ClO(OH)3H2O得到的电子的物质的量为![]() ×2=
×2=![]() mol,Cl2得到的电子的物质的量为
mol,Cl2得到的电子的物质的量为![]() ×2=
×2=![]() mol,所以
mol,所以![]() mol∶
mol∶![]() mol=0.42。
mol=0.42。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硅及其化合物在材料领域中应用广泛.下列说法正确的是
A. 硅酸钠可用于制备木材防火剂
B. 硅单质广泛用于光纤通讯
C. 利用盐酸刻蚀石英制作艺术品
D. 水晶项链是硅酸盐制品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础,研究物质的组成、结构、性质及其变化规律的自然科学。学习科学研究的基本方法,可以加深对科学本质的认识,增进对物质世界的认识。下列有关叙述不正确的是

A. 用测定接近水的沸点的水蒸气相对分子质量的方法可知水分子间可以形成氢键
B. 相对分子质量的测定常用质谱仪,在质谱仪内,有机化合物分子在高真空环境下被高能电子束轰击后主要形成带负电的碎片
C. 利用红外光谱、核磁共振氢谱等现代物理方法或化学方法均可测定C2H6O的分子结构
D. 某有机物分子式为C11H14O2,其H—NMR图谱如右图(峰右侧或上面的数字表示H的个数,且知:7.2ppm(5H)为苯基),可推测该有机物可能为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于一定体积密闭容器中的反应:N2(g)+3H2(g)![]() NH3(g)(正反应为放热反应),673K、30MP下,n (NH3)和n (H2)随时间t变化的关系如图所示.下列叙述中,不正确的是()
NH3(g)(正反应为放热反应),673K、30MP下,n (NH3)和n (H2)随时间t变化的关系如图所示.下列叙述中,不正确的是()

A. 点c处正反应速率比逆反应速率大 B. 点a的正反应速率比点b的正反应速率大
C. 气体的平均摩尔质量:点b大于点a D. 混合气体的密度:点b大于点a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知含铜离子的颜色主要有Cu(H2O)42+(蓝色)、CuCl42(黄色)、Cu(NH3)42+(深蓝色)等。
(1)16g铜在足量的氯气中燃烧生成固体产物放出的热量为56.8kJ。写出铜在氯气中燃烧的热化学方程式为______________________________________。
(2)向氯化铜溶液中滴加氨水至过量,最终生成Cu(NH3)42+,观察到的现象是________。
(3)CuCl2溶液中的铜主要以Cu(H2O)42+、CuCl42形式存在,将CuCl2溶于浓盐酸中,存在下列平衡:Cu(H2O)42+ (aq)+4Cl (aq)![]() CuCl42 (aq)+4H2O(l) △H<0
CuCl42 (aq)+4H2O(l) △H<0
①该反应的平衡常数表达式为____________。
②常温下,测定平衡体系中:Cu(H2O)42+浓度为a mol·L1、Cl浓度为b mol·L1、CuCl42浓度为c mol·L1,Cl的转化率为____________(用含a、b、c的字母表示)。
③将c1 mol·L1CuCl2溶液和c2 mol·L1 HCl溶液等体积混合,测得混合溶液中c(Cl)与温度T的关系如右图所示。简述温度高于T1 K时,随着温度升高,c(Cl)增大的原因___________。

④用惰性电极电解浓度较大CuCl2溶液,阳极的电极反应式为_________________,当电解到一定程度,阴极附近出现蓝色Cu(OH)2絮状物。常温下,经测定阴极附近溶液的pH=m,
此时阴极附近c(Cu2+)=___________ mol·L1 (已知:Cu(OH)2的Ksp=2.2×1020)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表述一定正确的是
A.甲醛的电子式:![]()
B.苯酚钠溶液中中通入少量二氧化碳气体:![]()
C.溴乙烷与氢氧化钠水溶液共热:![]()
D.乙醇与灼热的氧化铜反应:CH3CH2OH+CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有3个核酸分子,经分析共有5种碱基,8种核苷酸,4条多核苷酸链,它的组成是( )
A. 1个RNA、2个DNA B. 3个DNA
C. 1个DNA、2个RNA D. 3个RNA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增
加了3.6 g,则原混合气体的平均式量为
A. 5.8 B. 11.6 C. 23.2 D. 46.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com