
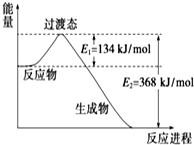
 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234KJ/mol.
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234KJ/mol.分析 (1)NO2(g)+CO(g)=CO2(g)+NO(g)△H=E1-E2;
(2)可以先根据反应物和生成物书写化学方程式,根据盖斯定律计算反应的焓变,最后根据热化学方程式的书写方法来书写热化学方程式;
(3)0.3g的乙烷和足量的氧气完全燃烧,生成液态水和CO2,并放出68.35kJ热量,则1mol乙烷放出的热量为68.35kJ×$\frac{30g}{0.3g}$=6835kJ,根据盖斯定律计算.
解答 解:(1)NO2和CO反应的热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g)△H=E1-E2=134 kJ/mol-368 kJ/mol=-234KJ/mol,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234KJ/mol;
(2)已知:①C (s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1;
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ•mol-1;
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H2=-2599kJ•mol-1;
2C (s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$得到,
所以反应焓变△H=2×(-393.5kJ•mol-1)+(-571.6kJ•mol-1)×$\frac{1}{2}$-(-2599kJ•mol-1)×$\frac{1}{2}$=+226.7kJ•mol-1,
故答案为:+226.7kJ•mol-1;
(3)0.3g的乙烷和足量的氧气完全燃烧,生成液态水和CO2,并放出68.35kJ热量,则1mol乙烷放出的热量为68.35kJ×$\frac{30g}{0.3g}$=6835kJ,该反应的热化学方程式为C2H6(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(l)△H=-6835 KJ/mol;
1mol水蒸气转化生成液态水放热44kJ,则3H2O(l)=3H2O(g)△H=+132 kJ/mol,所以C2H6(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(g)△H=-6835 kJ/mol+132 kJ/mol=-6703 kJ/mol,
故答案为:C2H6(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(l)△H=-6835 kJ/mol;-6703 kJ/mol.
点评 本题考查了热化学方程式书写和盖斯定律计算应用,难度中等,明确盖斯定律并掌握反应热的计算方法是解题关键.


科目:高中化学 来源: 题型:解答题
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液与FeCl3反应:HSO3-+2 Fe3++H2O═SO42-+2Fe2++3H+ | |
| B. | NaHSO3溶液和足量Ca(OH)2溶液反应:Ca2++OH-+HSO3-═CaSO3↓+H2O | |
| C. | NaHSO3溶液和稀HNO3反应:HSO3-+H+═SO2↑+H2O | |
| D. | NaHSO3溶液和NaAlO2溶液反应:HSO3-+AlO2-+H2O═SO32-+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若Ⅰ达平衡时,A、B、C各增加1mol,则A的转化率将一定增大 | |
| B. | 若向Ⅰ平衡体系中再加入1molA和3molB,C的体积分数若大于x,可断定n>3 | |
| C. | 若Ⅱ体系起始物质的量当满足9a+c=3b,则可判断n=3 | |
| D. | 若n=2,则Ⅱ体系起始物质的量应满足1<b<3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
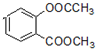 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O.
+H2O.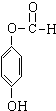 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)3COH的名称:2,2二甲基乙醇 | B. | 乙醛的结构式:CH3CHO | ||
| C. | CH4分子的比例模型: | D. | 聚丙烯的结构简式为: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com