
【题目】用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯的结构简式为______________________________
(2)![]() 名称为_______________________________________
名称为_______________________________________
(3)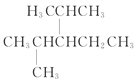 名称为:________________________________
名称为:________________________________
(4)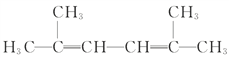 名称为:_______________
名称为:_______________
(5)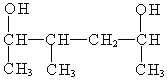 名称为:___________________________
名称为:___________________________
【答案】 ![]() 1-甲基-3-乙基苯 2,4-二甲基-3-乙基戊烷 2,5-二甲基-2,4-己二烯 3-甲基-2,5-己二醇
1-甲基-3-乙基苯 2,4-二甲基-3-乙基戊烷 2,5-二甲基-2,4-己二烯 3-甲基-2,5-己二醇
【解析】(1)3-甲基-2-丙基-1-戊烯的结构应该是主链有5个碳,在第一个和第二个碳原子之间有双键,在第二个碳原子上连丙基(正丙基),在第三个碳原子上连甲基,所以结构为![]() 。
。
(2)![]() 的命名应该以苯环作为母体,将甲基和乙基作为取代基,规定甲基连接的碳原子位次较小,所以认为甲基连接的碳原子为1号,则乙基连在3号碳原子上,名称为1-甲基-3-乙基苯。
的命名应该以苯环作为母体,将甲基和乙基作为取代基,规定甲基连接的碳原子位次较小,所以认为甲基连接的碳原子为1号,则乙基连在3号碳原子上,名称为1-甲基-3-乙基苯。
(3)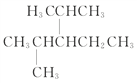 的主链上只可能有5个碳原子,同时应该选择支链最多的主链进行命名,本题应该选择的主链是
的主链上只可能有5个碳原子,同时应该选择支链最多的主链进行命名,本题应该选择的主链是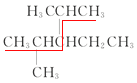 ,所以名称为2,4-二甲基-3-乙基戊烷。
,所以名称为2,4-二甲基-3-乙基戊烷。
(4)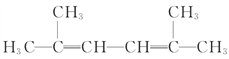 选择水平的链为主链,在2、3位和4、5之间有碳碳双键,所以主链名称为2,4-己二烯,加上两个位置的甲基,所以名称为2,5-二甲基-2,4-己二烯。
选择水平的链为主链,在2、3位和4、5之间有碳碳双键,所以主链名称为2,4-己二烯,加上两个位置的甲基,所以名称为2,5-二甲基-2,4-己二烯。
(5)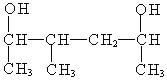 以包含连接有羟基官能团的两个碳原子的最长链为主链,因为主链上两个官能团的位置,无论从哪一侧开始编号都是2位和5位,所以应该以甲基取代基的位次最小进行编号,即从左侧开始,名称为:3-甲基-2,5-己二醇。
以包含连接有羟基官能团的两个碳原子的最长链为主链,因为主链上两个官能团的位置,无论从哪一侧开始编号都是2位和5位,所以应该以甲基取代基的位次最小进行编号,即从左侧开始,名称为:3-甲基-2,5-己二醇。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保持期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是
A. 无水硫酸铜、蔗糖 B. 硅胶(具有吸湿性)、硫酸亚铁
C. 食盐、硫酸亚铁 D. 生石灰、食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图。说法正确的是
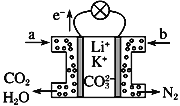
A. a为CH4,b为CO2 B. CO![]() 向正极移动
向正极移动
C. 此电池在常温时也能工作 D. 正极电极反应式为O2+2CO2+4e-===2CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
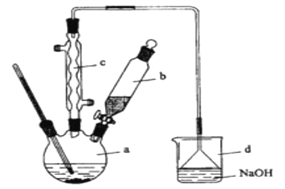
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/°C | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了_______气体。继续滴加至液溴滴完。装置d的作用是_____________;制取溴苯的化学方程式___________________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是:____________________。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是___;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填入正确选项前的字母)。
A.25mL B.50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10.6gNa2CO3溶于水配成1L溶液.
(1)该溶液中Na2CO3的物质的量浓度为 , 溶液中Na+的物质的量浓度为
(2)向该溶液中加入一定量的NaCl 固体,使溶液中Na+ 的物质的量浓度为0.4molL﹣1(假设溶液体积不变)需加入NaCl的质量为 , Cl﹣ 的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列离子方程式中,不能用离子反应方程式 SO42-+Ba2+=BaSO4↓来表示的
A. Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 B. BaCl2 + Na 2SO4=BaSO4↓+ 2NaCl
C. Ba(OH)2+H2SO4=BaSO4↓+2H2O D. BaCl2 +H2SO4=BaSO4↓+2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:; 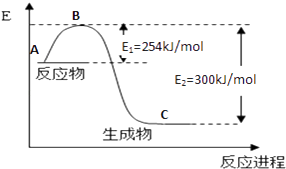
(2)若已知下列数据:
化学键 | H﹣H | N≡N |
键能/kJmol﹣1 | 435 | 943 |
试根据表中及图中数据计算N﹣H的键能kJmol﹣1
(3)合成氨反应通常用铁触媒作催化剂.使用铁触媒后E1和E2的变化是:E1 , E2(填“增大”、“减小、”“不变”).
(4)用NH3催化还原NOX还可以消除氮氧化物的污染.例如 4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=akJ/mol
N2(g)+O2(g)=2NO(g);△H2=bkJ/mol
若1mol NH3还原NO至N2 , 则该反应过程中的反应热△H3=kJ/mol(用含a、b的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1)生活中明矾常作净水剂,其净水的原理是________________________(用离子方程式表示)。
(2)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理________________________。
(3)去年8月12日晚,天津滨海新区危险品仓库发生爆炸事故,少量氰化物因爆炸冲击发生泄漏,CN一有剧毒,泄露会污染水源和空气,需要处理。
①已知HCN为一元弱酸,则NaCN溶液的pH _____________7(填“>”“=”或“<”),用离子方程式说明_____________________________。
②处理含CN一废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3一,同时生成NH3,该反应的离子方程式为___________________________________________________。
(4)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得溶液混合后的pH=5,写出MOH的电离方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某暗紫色化合物A在常温和干燥的条件下,可以稳定存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质.为探究其成分,某化学兴趣小组的同学取化合物A粉末进行实验.经组成分析,该粉末仅含有O、K、Fe三种元素,另取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应.过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g.
(1)化合物A的化学式为化合物A与H2O反应的离子方程式为: .
(2)化合物A可作为一种“绿色高效多功能”水处理剂,可由FeCl3和KClO在强碱性条件下反应制得,其反应的离子方程式为
(3)化合物A还可以作为高容量电池材料,与MnO2﹣Zn电池类似,A﹣Zn也可以组成碱性电池,A在电池中作为正极材料,其电极反应式为 , 该电池总反应的离子方程式为 .
(4)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展.下列物质中有可能提高化合物A水溶液稳定性的是
A.醋酸钠
B.醋酸
C.Fe(NO3)3
D.KOH
(5)请设计一个实验方案,研究温度对化合物A水溶液稳定性的影响: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com