
已知H2CO3的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11。向0.1mol/LNaOH溶液中通入CO2,若溶液的pH=10(不考虑溶液的体积变化),则下列说法正确的是
A. 2c(CO32-)+c(HCO3-)=0.1mol/L
B. 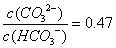
C. 该溶液中加BaCl2溶液,溶液pH增大
D. 在溶液中加水,使体积扩大到原来的10倍,则溶液pH明显变小
【知识点】弱电解质的电离平衡、盐类水解平衡
【答案解析】B 解析:A、电荷守恒有:2c(CO32-)+c(HCO3-)+ c(OH-)=c(Na+)+ c(H+);
溶液中c(Na+)=0.1mol/L,当PH=7时,c(H+)= cOH-),有2c(CO32-)+c(HCO3-)=0.1mol/L,而溶液的pH=10,,故A错误;B、Ka2= c(H+)·c(CO32-)/ c(HCO3-)=4.7×10-11 ,PH=10,c(H+)=10-10,代入得:c(CO32-)/ c(HCO3-)=0.47,故B正确;C、该溶液中加BaCl2溶液,生成碳酸钡沉淀,碳酸根浓度减小,水解造成的碱性程度减弱,PH减小,故C错误;D、在溶液中加水,使体积扩大到原来的10倍,若是强碱溶液PH减小1,而加水对弱离子水解起促进作用, pH变小不明显,故D错误。
故答案选B
【思路点拨】本题考查溶液中离子之间的关系,注意运用电荷守恒和电离常数表达式,题目难度中等。


科目:高中化学 来源: 题型:
配制250mL1mol/L的稀盐酸溶液,需要12mol/L的浓盐酸的体积为( )
|
| A. | 12mL | B. | 25mL | C. | 21mL | D. | 12.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的评价合理的是( )
| 实验事实 | 热化学方程式 | 评价 | |
| A | 已知H+(aq)+OH-(aq)===H2O(l) △H=-57.3 kJ·mol-1,将稀硫酸与稀氢氧化钡溶液混合 | H2SO4(aq)+Ba(OH)2(aq) ===BaSO4(s)+ 2H2O(l) △H=-114.6 kJ·mol-1 | 正确 |
| B | 醋酸与稀氢氧化钠溶液混合 | CH3COOH(aq)+NaOH(aq ===NaCl(aq)+H2O(l) △H=-57.3kJ·mol-1 | 不正确;因为醋酸状态为“aq”,而不是“l”。 |
| C | 160 g SO3气体与适量水恰好完全反应生成H2SO4,放出热量260.6 kJ | SO3(g)+H2O(l)===H2SO4(aq) △H=-130.3 kJ·mol-1 | 不正确;因为反应热为△H=-260.6kJ·mol-1 |
| D | 已知25℃、101 kPa下,120g石墨完全燃烧放出热量3935.1 kJ | C(s)+O2(g)===CO2(g) △H=-393.51 kJ·mol-1 | 不正确;同素异形体要注名称:C(石墨) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大
B.1 mol·L-1的NH4Cl溶液中含有NH4+的数目一定小于NA
C.用石墨电极电解FeCl3溶液,阴极反应:2Fe3++6H2O+6e-=2Fe(OH)3↓+3H2↑
D.将带有相反电荷的胶体混合,一定会出现胶体聚沉现象
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W四种元素原子序数依次增大且均小于36。 Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒, W基态原子有10个价电子。回答下列问题(以下问题均以推知元素符号作答):
(1)若 YX3与X2Z﹑YX2-与ZX-﹑Y3-与Z2-性质相似,请写出Mg(YX2)2在一定条件下分解的化学反应方程式
⑵已知0℃时X2Z的密度为a g/cm3,其晶胞中X2Z分子的空间排列方式与金刚石晶胞类似,相似的原因是 。两个X2Z分子间的最近距离为 pm(用a和NA表示)。已知X2Y的升华热是51 kJ/mol,除氢键外,X2Z分子间还存在范德华力(11 kJ/mol),则X2Z晶体中氢键的“键能”是 kJ/mol。
⑶ WZ是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。工业上常以W(YZ3)2·6X2Z和尿素[CO(NH2)2]为原料制备。
①W2+的基态核外电子排布式为 ,其核外电子有 种运动状态。
②尿素分子中碳原子的杂化方式为 ,1 mol尿素分子中含有的σ键数为 。
 ③YZ3-的空间构型 。
③YZ3-的空间构型 。
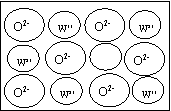
④WZ晶体的结构与NaCl相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如右图所示的缺陷:一个W2+空缺,另有两个W2+被两个W3+所取代。其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。经测定某样品中W3+与W2+的离子数之比为6∶91。若该晶体的化学式为WxZ,则x= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氨基甲酸铵(NH2COONH4)是一种白色固体,可用做肥料、灭火剂、洗 涤剂等。制备氨基甲酸铵的化学方程式如下:2NH3(g)+CO2(g) NH2COONH4(s) ΔH < 0,已知氨基甲酸铵有以下性质:
NH2COONH4(s) ΔH < 0,已知氨基甲酸铵有以下性质:
a.常温下在干燥的空气中稳定,遇水生成碳酸铵或碳酸氢铵;
b. 59℃则可分解成NH3和CO2气体;
用如图I装置制备干燥的氨气,图II装置制备氨基甲酸铵,把制备的干燥的氨气和二氧化碳通入四氯化碳中不断搅拌混合,当生成的氨基甲酸铵晶体悬浮在四氯化碳中较多时停止制备(注:四氯化碳与液体石蜡均为惰性介质)。

请回答下列问题:
(1)图I中,仪器B的名称 , A中的化学反应方程式是 ;
(2)图II装置中使用冰水的原因是 ;
(3)图II中液体石蜡鼓泡瓶的作用是 ;
(4)从图II反应后的混合物中分离出产品的方法是 ;
 A.蒸馏 B.过滤 C.分液 D.结晶
A.蒸馏 B.过滤 C.分液 D.结晶
(5)图II装置中,尾气处理装置如右图所示,玻璃管的作用 ,浓硫酸的作用是 和防止空气中水蒸气进入反应器使氨基甲酸铵水解;
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品7.82 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为10.0 g,则样品中氨基甲酸铵的质量分数为 (计算结果精确至0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )
A.野火烧不尽,春风吹又生 B.春蚕到死丝方尽,蜡炬成灰泪始干
C.粉身碎骨浑不怕,要留青白在人间 D.爆竹声中一岁除,春风送暖入屠苏
查看答案和解析>>
科目:高中化学 来源: 题型:
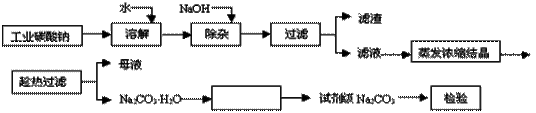
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:
已知碳酸钠的溶解度(S)随温度变化的曲线如图所示:

回答下列问题:
(1)滤渣的主要成分为_________________________。
(2)“趁热过滤”的原因是______________________。
(3)在实验室做Na2CO3·H2O脱水实验,判断其脱水完全的方法是:__________。
(4)生产过程中“母液”____(填“能”或“不能”)循环使用。若不能,其原因是:_________。
(5)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g);ΔH1= +532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g);ΔH2= +473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
溴化钙在医药上用作中枢神经抑制药,实验室用“尿素法”制备溴化钙的主要流程如下:

溴化钙的部分溶解度数值如下:
| 温度 | 0℃ | 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| 溶解度(g) | 125 | 132 | 143 | 213 | 278 | 295 | 312 |
(1)6Ca(OH)2+6Br2 50~70℃ 5CaBr2+6H2O+Ca(BrO3)2,每生成1 mol Ca(BrO3)2转移电子的物质的量为 ;50~70℃时,尿素[CO(NH2)2]将生成的Ca(BrO3)2还原为CaBr2,尿素被氧化为N2,该反应的化学方程式为 。
(2)过滤所需的玻璃仪器有玻璃棒、 , 。
(3)加入氢溴酸调pH的作用是 。
(4)操作I包括 、 、过滤、 、干燥。
(5)“二氧化硫法”制备的氢溴酸粗品中常含有少量的溴和硫酸;请选用所提供的试剂,补充完整检验氢溴酸粗品中是否含有Br2相SO42-的实验方案。
限选下列试剂:氯水、淀粉KI溶液、CCl4、BaCl2溶液、稀盐酸、植物油。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com