
【题目】现有三个体积相同的密闭容器,按下图所示投料,并在T℃条件下开始反应,其中容器I保持恒压100kPa。已知:分压=总压×物质的量分数,对于2NO2(g)![]() N2O4(g)ΔH<0,T℃时,标准平衡常数KΘ={p(N2O4)/100kPa}/{[p(NO2)] /100kPa}2=0.75, 式中p(N2O4) 、p(NO2)为气体分压。下列说法正确的是
N2O4(g)ΔH<0,T℃时,标准平衡常数KΘ={p(N2O4)/100kPa}/{[p(NO2)] /100kPa}2=0.75, 式中p(N2O4) 、p(NO2)为气体分压。下列说法正确的是

A. 达平衡时,容器Ⅱ中N2O4转化率小于50%
B. 达平衡时,容器Ⅰ中N2O4分压比容器Ⅲ中的大
C. 达平衡时,容器Ⅰ中N2O4的体积分数比容器Ⅱ中的大
D. 若起始时向容器Ⅲ中充入2molN2O4、2molNO2,达到平衡前v(正)<v(逆)
【答案】AD
【解析】若在恒温恒容条件下,三个容器中的反应为等效平衡。A.将容器Ⅰ中2molNO2转化为N2O4,可得1molN2O4,设有xmolN2O4反应生成NO2,根据已知条件容器I中保持恒压100kPa,T℃时,标准平衡常数KΘ={p(N2O4)/100kPa}/{[p(NO2)] /100kPa}2=0.75,可知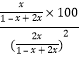 =0.75,解得x=0.5,因此N2O4转化率=
=0.75,解得x=0.5,因此N2O4转化率=![]() =50%,达到平衡时由于容器Ⅰ是绝热恒容,容器Ⅱ是恒温恒容,所以达到平衡时容器Ⅰ中的温度高于容器Ⅱ中的温度,而该反应是放热反应,因此平衡时容器Ⅱ中N2O4转化率小于50%,A正确;B. 容器Ⅰ是绝热恒容,达平衡时,容器Ⅰ中的温度高于容器Ⅲ中的温度,容器Ⅰ中N2O4的物质的量小于容器Ⅲ,因此容器Ⅰ中N2O4分压比容器Ⅲ中的小,B错误;C. 容器Ⅰ是绝热恒容,达平衡时,容器Ⅰ中的温度高于容器Ⅱ中的温度,导致容器Ⅰ中N2O4的物质的量小于容器Ⅱ,因此容器Ⅰ中N2O4的体积分数比容器Ⅱ中的小,C错误;D. 若起始时向容器Ⅲ中充入2molN2O4、2molNO2,由于容器Ⅲ保持恒温恒压,则必须扩大容器的体积,而该反应是气体体积减小的反应,所以在达到平衡前该反应一直向逆反应方向进行,因此达到平衡前v(正)<v(逆),D正确;答案选AD.
=50%,达到平衡时由于容器Ⅰ是绝热恒容,容器Ⅱ是恒温恒容,所以达到平衡时容器Ⅰ中的温度高于容器Ⅱ中的温度,而该反应是放热反应,因此平衡时容器Ⅱ中N2O4转化率小于50%,A正确;B. 容器Ⅰ是绝热恒容,达平衡时,容器Ⅰ中的温度高于容器Ⅲ中的温度,容器Ⅰ中N2O4的物质的量小于容器Ⅲ,因此容器Ⅰ中N2O4分压比容器Ⅲ中的小,B错误;C. 容器Ⅰ是绝热恒容,达平衡时,容器Ⅰ中的温度高于容器Ⅱ中的温度,导致容器Ⅰ中N2O4的物质的量小于容器Ⅱ,因此容器Ⅰ中N2O4的体积分数比容器Ⅱ中的小,C错误;D. 若起始时向容器Ⅲ中充入2molN2O4、2molNO2,由于容器Ⅲ保持恒温恒压,则必须扩大容器的体积,而该反应是气体体积减小的反应,所以在达到平衡前该反应一直向逆反应方向进行,因此达到平衡前v(正)<v(逆),D正确;答案选AD.


科目:高中化学 来源: 题型:
【题目】莫尔盐的化学式为( NH4)2Fe(SO4)2·6H2O,溶于水而不溶于乙醇,常被用作氧化还原滴定的基准物。下面是制取莫尔盐的部分装置与实验步骤:

①将铁屑放入小烧杯中,加适量的Na2CO3溶液,小火加热几分钟,倒掉溶液后,用蒸馏水洗净铁屑,晾干。
②在锥形瓶中加入2.24 g 铁屑和少量碳粉,由分液漏斗滴加20 mL 3 mol/L硫酸溶液。
③待反应结束后,由分液漏斗加入适量的(NH4)2SO4溶液,过滤。在滤液中加入一定量的乙醇,待晶体析出后,过滤、洗涤、晾干,得莫尔盐晶体。
请回答下列问题:
(1)实验开始前,检查反应器气密性的方法为_____________________。
(2)步骤①中Na2CO3溶液的作用是_____________________________________。
(3)步骤②中滴加硫酸溶液时留取少许溶液于分液漏斗中的原因是__________________,加入少量碳粉的作用是_________________________________________。
(4)步骤③中理论上需加入2 mol/L 的(NH4)2SO4溶液______________mL。
(5)取10.00 g铬青铜样品,将其中的铬氧化为H2CrO4,再加入硫酸酸化,并配成250mL溶液,取出25.00 mL用浓度为0.0180 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,终点时用去标准液20.75 mL。已知弱酸H2CrO4被还原为Cr3+,则滴定时反应的离子方程式为_____________________________________。该样品中铬元素的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。

(1)硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的横线上:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
①浓硫酸可以干燥氢气__________
②浓硫酸使木条变黑__________
③热的浓硫酸与铜片反应__________
(2)现用该浓硫酸配制100mL 1mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。请回答下列问题:
(i)配制稀硫酸时,上述仪器中不需要使用的有__________(选填序号),还缺少的仪器有__________(写仪器名称);
(ii)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为__________mL(保留一位小数),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸在下列反应中,既表现出氧化性,又表现出酸性的是
①Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
②C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
③2FeO+4H2SO4Fe2(SO4)3+SO2↑+4H2O
④Fe2O3+3H2SO4Fe2(SO4)3+3H2O
A. ①② B. ②③
C. ①③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka(CH3COOH)=1.75×10-5, Ka (HCN)=6.2×10-10,下列说法正确的是
A. 0.1mol/L CH3COONa溶液与0.1mol/L KCN溶液:c(Na+)-c(CH3COO-)> c(K+)-c(CN-)
B. 20mL0.1 mol/L CH3COONa与10mL 0.1 mol/L HCl溶液混合后所得酸性溶液:c(Na+)>c(CH3COOH)>c(CH3COO-)
C. 0.2 mol/LHCN溶液与0.1 mol/L NaOH溶液等体积混合所得溶液:c(Na+)>c(CN-)>c(OH-)>c(H+)
D. 向浓度均为0.1mol/L的CH3COOH和HCN混合溶液中滴加0.1mol/LNaOH溶液,当恰好中和时所得溶液: c(CH3COOH)+c(HCN)+c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿浆(软锰矿的主要成分是MnO2,还含有硅、铁、铝、钙、镁和少量重金属镍的化合物等杂质)为原料制取电解锰和四氧化三锰。

注:过量的软锰矿将Fe2+氧化为Fe3+。
(1)纤维素[(C6H10O5)n]还原MnO2时,发生反应的化学方程式为_______。
(2)已知:Kp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,加入NH3·H2O后,Al3+浓度为l×10-6mol/L时,溶液中Fe3+浓度为_________
(3)pH对除镍效果的影响如图1:

控制pH为4.5~5.0除镍效果最好,原因是__________
(4)电解MnSO4溶液制备电解锰,用惰性电极电解,阳极的电极反应式为________,为保证电解的顺利进行,电解液必须保持一定的Mn2+浓度。Mn2+浓度和电流效率的关系如图2所示。由图可知当Mn2+浓度大于22g/L时,电流效率随Mn2+浓度增大反而下降,其原因是________。

(5)MnSO4溶液制备四氧化三锰。氨水作沉淀剂,沉淀被空气氧化所得产品的X射线图见图3。
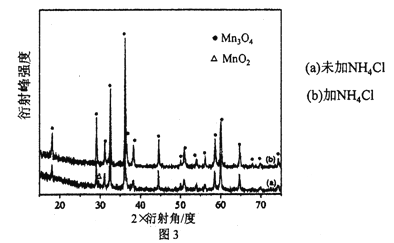
Mn2+形成Mn(OH)2时产生少量Mn2(OH)2SO4,加入NH4Cl会影响Mn2(OH)2SO4的氧化产物,写出NH4Cl存在时,Mn2(OH)2SO4被O2氧化发生反应的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,前者属于电解质,后者属于非电解质的是( )
A.NaCl晶体、BaSO4
B.铝、二氧化硫
C.液态的醋酸、酒精
D.熔融的KNO3、硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=7,则强碱与强酸的体积比是( )
A. 11∶1B. 10∶1C. 1∶11D. 1∶10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关,下列说法正确的是
A. 聚乙烯塑料的老化是因为发生了加成反应
B. 防腐剂福尔马林(含HCHO)可用作食品保鲜剂
C. “乙醇汽油”是在汽油中加入乙醇生成的一种新化合物
D. 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化的过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com