
【题目】(1)0.5mol CH4的质量是_____g,在标准状况下的体积为______L;含有约______个氢原子。
(2)将标准状况下22.4L的HCl溶于水配成200mL的溶液,所得溶液的物质的量浓度为______;配制300mL 0.5molL﹣1氯化钠溶液,需要1.5molL﹣1的氯化钠溶液的体积是______mL。
【答案】8g 11.2L 1.204×1024 5mol/L 100ml
【解析】
(1)0.5mol CH4的质量=nM=0.5mol×16g/mol=8g;标况下的体积为0.5mol×22.4L/mol=11.2L;每个甲烷分子中含有4个氢原子,所以0.5mol CH4的含有氢原子为0.5mol×4=2mol,即1.204×1024个,故答案为:8g;11.2L;1.204×1024;
(2)22.4L的HCl的物质的量为![]() =1mol,溶液的物质的量浓度
=1mol,溶液的物质的量浓度![]() ;300mL 0.5molL﹣1氯化钠溶液所含氯化钠的物质的量为0.5mol/L×0.3L=0.15mol,需要1.5molL﹣1的氯化钠溶液的体积V=
;300mL 0.5molL﹣1氯化钠溶液所含氯化钠的物质的量为0.5mol/L×0.3L=0.15mol,需要1.5molL﹣1的氯化钠溶液的体积V=![]() ,故答案为:5mol/L;100ml。
,故答案为:5mol/L;100ml。


科目:高中化学 来源: 题型:
【题目】K2Cr2O7是一种强氧化剂,在酸性条件下与乙醇发生如下反应: 3CH3CH2OH+2K2Cr2O7+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O

(1)Cr基态核外电子排布式为________。
(2)K、S、O三种元素的第一电离能由大到小的顺序为________。
(3)乙醇的沸点比甲醚(CH3OCH3)的高,主要原因是________。与H2O空间结构相同的一种阴离子为________(填化学式)。
(4)[Cr(H2O)5Cl]Cl2·H2O是铬(Ⅲ)的一种配合物,1 mol [Cr(H2O)5Cl]2+中含有σ键的数目为________。
(5)某铬铝合金是一种轻质高温材料,其晶胞结构如图所示,该晶体中n(Cr)∶n(Al)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲探究CO还原CuO,设计如图所示装置(夹持装置略去)。下列说法正确的是
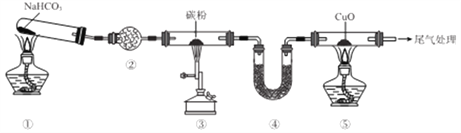
A. ②、④中均可盛装碱石灰
B. 加热的顺序为③、①、⑤
C. ①、③、⑤中均发生氧化还原反应
D. 可将尾气用导管通入到⑤的酒精灯处灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(实验1)探究草酸的制备:
实验室用硝酸氧化淀粉(C6H12O6)水解液法(水浴加热)制备草酸,其反应为:C6H12O6+12HNO3 = 3H2C2O4+9NO2↑+3NO↑+9H2O ,装置如图所示:
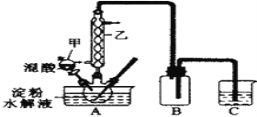
(1)仪器乙的名称为:_________,其接通冷水与水浴加热三颈瓶的先后顺序是:________
(2)烧杯C中盛放的溶液是___________,装置的B作用是______________
(实验2)探究草酸的不稳定性:
已知:草酸晶体(H2C2O4·2H2O)无色,易溶于水,熔点为101℃,受热易脱水、升华,170℃以上分解产生H2O、CO和CO2,其酸性比碳酸强,其钙盐难溶于水。
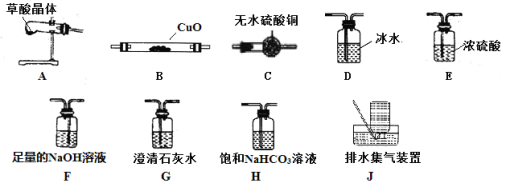
(3)请选取以上的装置证明草酸晶体分解的产物(可重复使用,加热装置和连接装置已略去)。仪器装置连接顺序为:A→_______→______→______→_______→E→B→G→_______。
(4)若实验结束后测得B管质量减轻4.8g,则至少需分解草酸晶体的质量为_________g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的固定和转化是世界性课题。兰州大学景欢旺教授团队巧妙设计构建了系列新型光电催化人工光合成体系——光电催化池,p-n半导体异质结催化CO2在水中直接制备长碳链有机物并放出氧气,原理如图,下列说法不正确的是

A.电极1的电势比电极2的电势高
B.该设计向大自然学习,模仿植物的光合作用
C.电子从a极流到电极1,从电极2流到b极
D.负极区,p-n为催化剂,CO2发生还原反应生成长碳链有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现对三种不同的镁铝合金样品进行编号,做以下实验探究。
(1)取样品①m1g,加入过量NaOH溶液,充分反应后过滤;往滤液中通入过量CO2气体:将所得沉淀过滤、洗涤、烘干,灼烧,得到固体的质量仍然为m1g.合金中镁的质量分数为_____(保留2位小数,下同)。
(2)取样品②m2g,与足量稀硫酸反应,固体完全溶解时得到气体的体积为VL(标准状况)。m2的取值范围是_____。
(3)取样品③0.918g与30.00mL、2.00mL盐酸充分反应后,得到672mL气体(标准状况)。剩余合金0.306g(认为合金中镁、铝与酸的反应同时发生)。然后在反应后所得体系中继续加1.00mol/L的NaOH溶液,恰好使所有铝元素均不以沉淀形式存在。则需要加入1.00mol/L的NaOH溶液_____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
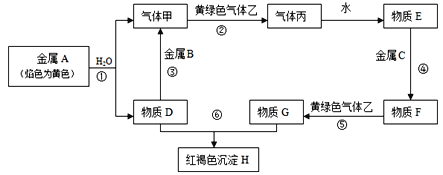
请回答下列问题:
(1)写出下列物质的化学式:B_____________, C_______________,F_____________, 乙_______________,
(2)写出下列反应的离子方程式:反应①____________________;反应⑤____________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光电池在光照条件下可产生电流,如图装置可以实现光能源的充分利用,双极性膜可将水解离为H+和OH-,并实现其定向通过。下列说法不正确的是( )

A.该装置可利用光能实现水的分解
B.光照过程中阴、阳极区溶液中的pH均基本不变
C.再生池中的反应为2V2++2H+![]() 2V3++H2↑
2V3++H2↑
D.每有1molOH-通过双极性膜,可产生5.6L(标准状况)的O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室探究SO2与Fe(NO3)3溶液反应的原理,装置如下图,实验中Y装置产生白色沉淀。下列说法不正确的是
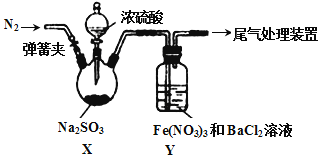
A. 滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2
B. Y中产生的白色沉淀是BaSO4或BaSO3
C. 产生白色沉淀的原因可能是在酸性条件下SO2与NO3- 反应生成了SO42-
D. 若将Fe(NO3)3换成FeCl3,Y中也能产生白色沉淀,说明Fe3+也能将SO2氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com