
下列电离方程式中,正确的是( )
|
| A. | Na2SO4=2Na++SO4﹣2 |
|
| B. | Ba(OH)2⇌Ba2++2OH﹣ |
|
| C. | NaHCO3=Na++H++CO32﹣ |
|
| D. | NH4Fe(SO4)2=NH4++Fe3++2SO42﹣ |
| 电离方程式的书写. | |
| 专题: | 离子反应专题. |
| 分析: | A.硫酸根离子书写错误; B.氢氧化钡为强电解质,完全电离,用等号; C.碳酸氢根离子为多元弱酸的酸式根离子,不能拆; D.硫酸铁铵为强电解质,完全电离. |
| 解答: | 解:A.硫酸钠电离方程式为:Na2SO4=2Na++SO42﹣,故A错误; B.氢氧化钡电离方程式为:Ba(OH)2=Ba2++2OH﹣,故B错误; C.碳酸氢钠电离方程式为:NaHCO3=Na++HCO3﹣,故C错误; D.硫酸铁铵电离方程式为:NH4Fe(SO4)2=NH4++Fe3++2SO42﹣,故D正确. 故选:D. |
| 点评: | 本题考查了电解质电离方程式的书写,明确电解质的强弱及电离方式是解题关键,题目难度不大. |


科目:高中化学 来源: 题型:
在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g)  3C(g),已知加入1 mol A和3 mol B且达到平衡后,生成了a mol C。
3C(g),已知加入1 mol A和3 mol B且达到平衡后,生成了a mol C。
(1)达到平衡时,C在反应混合气中的体积分数是__________(用含字母a的代数式表示)。
(2)在相同实验条件下,若在同一容器中改为加入2 mol A和6 mol B,达到平衡后,C的物质的量为_______mol(用含字母a的代数式表示),此时C在反应混合气中的体积分数与原平衡相比___________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
标准生成热指的是在某温度下,由处于标准状态的各种元素的最稳定的单质生成标准状态下1 mol某纯物质的热效应,单位常用kJ·mol-1表示。已知在25℃的条件下:
Ag2O(s)+2HCl(g)===2AgCl(s)+H2O(l) ΔH1=-324.4 kJ·mol-1
2Ag(s)+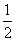 O2(g)===Ag2O(s) ΔH2=-30.56 kJ·mol-1
O2(g)===Ag2O(s) ΔH2=-30.56 kJ·mol-1
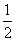 H2(g)+
H2(g)+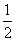 Cl2(g)===HCl(g) ΔH3=-92.21 kJ·mol-1
Cl2(g)===HCl(g) ΔH3=-92.21 kJ·mol-1
H2(g)+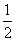 O2(g)===H2O(l) ΔH4=-285.6 kJ·mol-1
O2(g)===H2O(l) ΔH4=-285.6 kJ·mol-1
则25℃时氯化银的标准生成热为( )
A.-126.89 kJ·mol-1 B.-324.4 kJ·mol-1
C.-30.56 kJ·mol-1 D.题中数据不足,无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在体积为2 L的密闭容器中,充入1 mol 气体A和a mol气体B,发生如下反应:A(g)+B(g)2C(g)。5 min 后反应达到平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如图所示。下列叙述正确的是(双选)( )
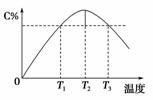
A.0~5 min,C物质的平均反应速率为0.12 mol·L-1·min-1
B.图中T1时正反应速率等于T3时正反应速率
C.该反应T2时的平衡常数大于T3时的平衡常数
D.图中T2时,若只增大压强,则正、逆反应速率不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg5种金属中的一种.已知:
(1)a、c均能与稀硫酸反应放出气体;
(2)b与d的硝酸盐反应,置换出单质d;
(3)c与强碱反应放出气体;
(4)c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为( )
|
| A. | Fe Cu Al Ag Mg |
|
| B. | Al Cu Mg Ag Fe |
|
| C. | Mg Cu Al Ag Fe |
|
| D. | Mg Ag Al Cu Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
表中,对陈述Ⅰ、Ⅱ的正确性及两者之间是否具有因果关系判断都正确的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 碳酸钠可用于治疗胃酸过多 | Na2CO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 将Na2O2投入水中充分反应后,滴入酚酞变红 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 高压钠灯发生透雾性强的黄光 | Ⅰ对,Ⅱ对,有 |
| D | 保存NaOH溶液的试剂瓶用橡皮塞 | NaOH能与玻璃中的SiO2发生反应 | Ⅰ对,Ⅱ对,有 |
|
| A. | A、 | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关氧化还原反应的判断中正确的是( )
|
| A. | 金属单质与盐溶液不一定发生置换反应 |
|
| B. | 侯氏制碱法的原理属于氧化还原反应 |
|
| C. | 阳离子只有氧化性,阴离子只有还原性 |
|
| D. | 失电子的数目越多,说明该物质的还原性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列8种符号: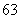 Li、
Li、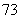 Li、
Li、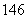 C、
C、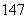 N、
N、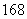 O、
O、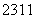 Na、
Na、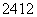 Mg、
Mg、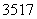 Cl
Cl
(1)包含________种元素,________种核素,其中互为同位素的是__________。
(2)氯离子的结构示意图为________。
(3)原子最外层电子数是次外层电子数2倍、3倍的分别是________、________。
(4)质量数相等的是________和________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com