
����Ŀ��X��Y��Z��Q��MΪ�����Ķ�����Ԫ�أ���ԭ���������������й���Ϣ�����
X | ��ֲ����������ȱ�ٵ�Ԫ�أ��ǵ����ʵ���Ҫ�ɷ� |
Y | �ؿ��к����ӵ�һλ |
Z | ����������ԭ�Ӱ뾶��� |
Q | �����д���ʹ����Ͻ���Ʒ����ҵ�Ͽ��õ����������ķ����Ʊ��䵥�� |
M | ��ˮ�д���������Ԫ��֮һ������������ϼ��븺�۵Ĵ�����Ϊ6 |
��1��X����̬�⻯��Ĵ���������������˵���������ʳ��������µļ������������⣬��д������̬�⻯��ĵ���ʽ ��
��2����֪37Rb��53I��λ�ڵ������ڣ��ֱ���Z��Mͬһ���壮�����й�˵����ȷ����������ţ���
A.ԭ�Ӱ뾶��Rb��I
B.RbM�к��й��ۼ�
C.��̬�⻯�����ȶ��ԣ�M��I
D.Rb��Q��M������������Ӧ��ˮ�����������������Ӧ
��3��������QX�����Ժã�������ϵ��С�������õ����ȳ�����ϣ��йػ�����QX���Ʊ�����ѧ�������£������������ݾ����ۺ�Ϊ25�桢101.3 kPa�����µ���ֵ�����ٿ���Q��X�ĵ�����800��1 000���Ƶã�ÿ����1 mol QX������a kJ��������
�ڿ���Q���������̿��X�ĵ�����1 600��1 750������QX��ÿ����18 g̼����1 mol QX������b kJ��������
�����������Ϣд����������Q�����������̿��Ӧ����Q���ʺ�CO���Ȼ�ѧ����ʽ ��
��4��X��Y��ɵ�һ����ɫ������������Ϊ����ɫ����״���½�40 L����ɫ������15 L����ͨ��һ��Ũ�ȵ�NaOH��Һ�У�ǡ�ñ���ȫ���գ�ͬʱ���������Σ���д���÷�Ӧ�����ӷ���ʽ ��
���𰸡�
��1��![]()
��2��ACD
��3��Al2O3��s��+3C��s��=2Al��s��+3CO��g����H=��2b��2a�� kJ/mol
��4��8NO+3O2+8OH��=2NO2��+6NO ![]() +4H2O
+4H2O
���������⣺X��Y��Z��Q��MΪ�����Ķ�����Ԫ�أ���ԭ��������������XԪ���Ƕ�ֲ����������ȱ�ٵ�Ԫ�أ��ǵ����ʵ���Ҫ�ɷ֣���XΪNԪ�أ�YԪ���ڵؿ��к����ӵ�һλ����YΪOԪ�أ�Z�Ƕ���������ԭ�Ӱ뾶����Ԫ�أ���ZΪNa��Q�������д���ʹ����Ͻ���Ʒ����ҵ�Ͽ��õ����������ķ����Ʊ��䵥�ʣ���QΪAl��M�Ǻ�ˮ�д���������Ԫ��֮һ������������ϼ��븺�۵Ĵ�����Ϊ6����MΪCl����1��X����̬�⻯��Ĵ���������������˵���������ʳ��������µļ������������⣬����̬�⻯��ΪNH3 �� ����ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����2��A��Rb��Iͬ���ڣ��˵����Խ��ԭ�Ӱ뾶ԽС����ԭ�Ӱ뾶��Rb��I����A��ȷ�� B��RbI�к������Ӽ�����B����
����2��A��Rb��Iͬ���ڣ��˵����Խ��ԭ�Ӱ뾶ԽС����ԭ�Ӱ뾶��Rb��I����A��ȷ�� B��RbI�к������Ӽ�����B����
C���ǽ�����Cl��I������̬�⻯�����ȶ��ԣ�HCl��HI����C��ȷ��
D��Rb��Q��M������������Ӧ��ˮ����ֱ�ΪRbOH�������ᡢ����������RbOH���Ա�NaOH��ǿ��������������RbOH�������ᷴӦ��RbOH������ᷢ���кͷ�Ӧ����D��ȷ��
��ѡ��ACD����3����Al�͵����ĵ�����800��1 000���Ƶ�AlN��ÿ����1 mol AlN������a kJ���������ɵ��Ȼ�ѧ����ʽ�٣�Al��s��+ ![]() N2��g��=AlN��s����H=+a kJ/mol��
N2��g��=AlN��s����H=+a kJ/mol��
������������̿�͵���1 600��1 750������Al��ÿ����18 g̼����1 mol AlN������b kJ���������ɵ��Ȼ�ѧ����ʽ�ڣ� ![]() Al2O3��s��+
Al2O3��s��+ ![]() N2��g��+
N2��g��+ ![]() C��s��=AlN��s��+
C��s��=AlN��s��+ ![]() CO��g����H=+b kJ/mol��
CO��g����H=+b kJ/mol��
���ݸ�˹���ɣ��ڡ�2���١�2�ɵã�Al2O3��s��+3C��s��=2Al��s��+3CO��g����H=��2b��2a�� kJ/mol��
���Դ��ǣ�Al2O3��s��+3C��s��=2Al��s��+3CO��g����H=��2b��2a�� kJ/mol����4��X��Y��ɵ�һ����ɫ������������Ϊ����ɫ��������ΪNO����״���½�40 LNO��15 L����ͨ��һ��Ũ�ȵ�NaOH��Һ�У�ǡ�ñ���ȫ���գ�ͬʱ���������Σ�������NaNO2��NaNO3 �� �÷�Ӧ�����ӷ���ʽΪ��8NO+3O2+8OH��=2NO2��+6NO3��+4H2O��
���Դ��ǣ�8NO+3O2+8OH��=2NO2��+6NO3��+4H2O��


 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����Ȼ�ѧ����ʽ�У���ѧ��Ӧ�ġ�Hǰ�ߴ��ں��ߵ��ǣ� ��
��C��s��+O2��g���TCO2��g������H1 C��s��+ ![]() O2��g���TCO��g������H2
O2��g���TCO��g������H2
��S��s��+O2��g���TSO2��g������H3 S��g��+O2��g���TSO2��g������H4
��H2��g��+ ![]() O2��g���TH2O��l������H5 2H2��g��+O2��g���T2H2O��l������H6
O2��g���TH2O��l������H5 2H2��g��+O2��g���T2H2O��l������H6
��CaCO3��s���TCaO��s��+CO2��g������H7 CaO��s��+H2O��l���TCa��OH��2��s������H8 ��
A.��
B.��
C.�ڢۢ�
D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ȼ�������е�����������������ԭ��Ӧ���ǣ� ��
A. ������� B. ֲ�������� C. �������� D. ʯ����ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪CH4��g��+2O2��g���TCO2��g��+2H2O��l������H=��Q1kJmol��1 �� 2H2��g��+O2��g��=2H2O��g������H2=��Q2 kJmol��1 �� 2H2��g��+O2��g��=2H2O��l������H2=��Q3 kJmol��1 ��
�����£�ȡ�����4��1�ļ���������Ļ������11.2L����״���£�������ȫȼ�պ�ָ������£���ų�������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� (����)
A.����ֻ�ܼӿ컯ѧ��Ӧ����
B.����Ӱ��ijЩ��ѧ��Ӧ���ʵ��������֮һ
C.������ѧ��Ӧ���ʵ���Ҫ������Ũ��
D.����ʲô��Ӧ������Ũ�ȣ�����ȣ����ѹ�������Լӿ췴Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж��ֺ����ᣬ�����ᣨH2SO3�������ᣨH2SO4���������ᣨH2SO4SO3����������ᣨH2S2O3���ȵȣ�����������Ϊ��Ҫ���ڹ�ҵ���й㷺��Ӧ�ã���ʵ���ң�Ũ�����dz��õĸ������������м��㣺
��1�������ᣨH2SO4 �� SO3������ˮ�����е�SO3��ת��Ϊ���ᣮ����445g����������ˮ���4.00L���ᣬ����������ʵ���Ũ��Ϊmol/L��
��2������Ũ������ˮ������H2SO4 �� H2O���㣬250g��������Ϊ98%�����������ն���gˮ��
��3���������ǹ�ҵ�����������Ҫԭ�ϣ��������������յĻ�ѧ��Ӧ���£�3FeS2+8O2��Fe3O4+6SO2 4FeS2+11O2��2Fe2O3+8SO2
��48molFeS2��ȫ��Ӧ��������2934.4L����״���������㷴Ӧ������Fe3O4��Fe2O3���ʵ���֮�ȣ�
��4����������ȡ���ᣬ���ܳ��������Դ���ܱ�����������һ�ֺ��з�չǰ;���Ʊ�����ķ����������������Ϊ0.84�Ļ�����壨H2S��H2O��N2���ڿ�������ȫȼ�գ�����������77%���������������SO2���������ˮ�����壩��
��֪������ɣ�N2�������0.79��O2�������0.21��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������[KAl(SO4)2��12H2O]��һ���Σ�����ֽ�ȷ���Ӧ�ù㷺��ij��ȤС�����10.0g��������(��90%��Al��������������Fe��Mg�����ʣ��Ʊ�������ʵ�鷽�����£�
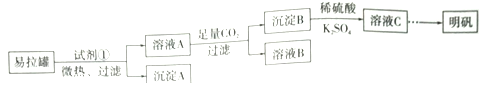
��1���Լ���Ӧѡ��_____________(����ţ���
a.���� b.H2SO4��Һ c.�Ȼ�����Һ d.NaOH��Һ
��2���������ܽ��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ____________________��
��3����ҺB�����ʵ���Ҫ�ɷ�Ϊ____________________ (�ѧʽ)��
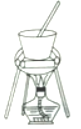
��4������ҺC�еõ�������ʵ���������Ϊ����Ũ����__________(��������ƣ������ˡ�ϴ�ӡ��������ͼ��ʾ�����������е�һ��������_____________��
��5����С����ʵ�����֮�õ�118.5 g�������������Ļ�����Ϊ_____________������֪��������Ħ������Ϊ474g��mol-1)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������෴Ӧ�����û���Ӧ �ڸ��ֽⷴӦ ��ֻ��һ��Ԫ�ػ��ϼ۷����仯�ķ�Ӧ �����ӷ�Ӧ������һ������������ԭ��Ӧ���ǣ� ��
A. ֻ�Т� B. ֻ�Т� C. ֻ�Тڢ� D. �٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֱ���ʢ�е��ۡ�����Һ�����ձ��еμ����ʻƹ�֭�;��ûƹ�֭���ƹ�֭�к��е�ά����C��ʹ���ۡ�����Һ��ɫ��ʵ�������±�������˵������ȷ����( )
�ƹ�֭ | ���� | ���� |
���� | 12 | 20 |
A.ά����C���л�ԭ�ԣ��ܽ��ⵥ�ʻ�ԭΪI��
B.ʵ��ʱ���ձ��еĵ��ۡ�����Һ��Ũ�Ⱥ�������
C.���ʻƹ�֭�бȾ��ûƹ�֭��ά����C������
D.ά����Cȱ���IJ���Ҫ������ʵ��߲˺�ˮ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com