
| A. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 | |
| B. | 用水作电解质溶液 | |
| C. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| D. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS |
分析 Li和Al都属于金属,合金中Li较Al活泼,根据正极反应式知,原电池的电极材料Li-Al/FeS,判断出负极材料为Li,发生反应为:Li-e-═Li+,又知该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe,所以电池反应为:2Li+FeS═Li2S+Fe,充电时为电解池原理,阴极发生还原反应,反应式是2Li++2e-═2Li.
解答 解:A、Li和Al都属于金属,在电池中作为负极材料,所以Li-Al应该属于合金而不是化合物,因此化合价为0价,故A错误;
B、Li和水反应生成LiOH和氢气,所以电解质溶液不能是电解质的水溶液,故B错误;
C、根据正极反应2Li++FeS+2e-═Li2S+Fe与负极反应2Li-2e-═2Li+相加可得反应的电池反应式为:2Li+FeS═Li2S+Fe,故C正确;
D、充电时为电解池原理,阴极发生还原反应,正确的反应式是2Li++2e-═2Li,故D错误.
故选C.
点评 本题涵盖电解池和原电池的主体内容,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写.


科目:高中化学 来源: 题型:选择题
| A. | 10mol 10% | B. | 20mol 20% | C. | 20mol 40% | D. | 30mol 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入含紫色石蕊试液的水中 | 溶液先变红后褪色 | SO2有漂白性 |
| B | 将纯Fe(NO3)2样品溶于稀H2SO4中,滴加KSCN溶液 | 溶液变红 | HNO3氧化性强于Fe3+的氧化性 |
| C | 将新制氯水和KI溶液在试管中混合后,加入CCl4,振荡静置 | 溶液分层,下层呈紫色 | 非金属性:Cl>I |
| D | 分别向0.1mol•L-1醋酸和饱和硼酸溶液中滴加0.1mol•L-1Na2CO3溶液 | 醋酸中有气泡产生,硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 12种 | C. | 16种 | D. | 32种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 加热煮沸的主要目的是除去溶液中溶解的氧气 | |
| B. | 稀释过程中用到的玻璃仪器主要有烧杯、玻璃棒、胶头滴管 | |
| C. | 滴定过程中可用淀粉溶液作指示剂 | |
| D. | 铁矿石中铁的质量分数为70% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
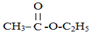 相关物质间转化关系如图:
相关物质间转化关系如图: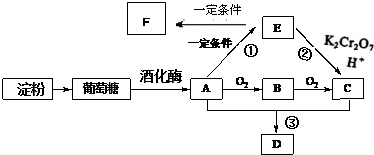
 +CH2CH2OH$?_{△}^{浓硫酸}$
+CH2CH2OH$?_{△}^{浓硫酸}$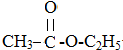 +H2O
+H2O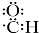

 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
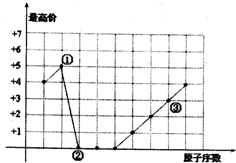
| A. | ①、②形成的化合物的摩尔质量可能是44g/mol | |
| B. | ①、③可以按原子个数比1:l形成化合物 | |
| C. | ②、③形成的化合物是两性物质 | |
| D. | 单核简单离子半径大小为:②<③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com