计算题:在由铜片、锌片和200mL稀硫酸组成的原电池中,当在铜片上放出3.36L(标准状况)的H2时,硫酸恰好用完,则:
(1)产生这些气体消耗的锌的质量是______ 克;
(2)通过导线的电子的物质的量是______ mol
(3)原稀硫酸的物质的量浓度是______ mol/L.
【答案】
分析:(1)根据氢气和锌的关系式计算;
(2)根据氢气和转移电子的关系式计算;
(3)根据氢气和硫酸的关系式计算硫酸的物质的量,再根据物质的量浓度公式计算硫酸的物质的量浓度;
解答:解:(1)Zn+H
2SO
4 =ZnSO
4 +H
2↑
65g 22.4L
9.75g 3.36L
故答案为9.75;
(2)Zn+H
2SO
4 =ZnSO
4 +H
2↑ 转移电子
22.4L 2 mol
3.36L 0.3mol
故答案为0.3;
(3)Zn+H
2SO
4 =ZnSO
4 +H
2↑
1mol 22.4L
0.15mol 3.36L
溶液中硫酸的物质的量为0.15mol;
所以稀硫酸的物质的量浓度C=
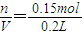
=0.75mol/L
故答案为0.75;
点评:本题以原电池为载体考查了反应方程式的有关计算,正确找出各物质间的关系是解本题的关键.

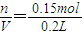 =0.75mol/L
=0.75mol/L
