
【题目】25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题: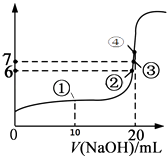
(1)若0.1mol/L的氢氟酸溶液中有0.1%的HF发生电离,则溶液的pH=;
(2)滴加NaOH溶液至恰好反应的过程中,水的电离程度(填写“逐渐增大”、“不变”、“逐渐减小”);
(3)①点时,NaOH加入了10mL,此时溶液中各种微粒(不包括水)的浓度由大到小的顺序是;
(4)③点时pH=7,此时溶液中c(F﹣)c(Na+)(填写>、<或=);
(5)④点时,NaOH加入了20mL,此时溶液中有两种微粒浓度之和等于0.05mol/L,这两种微粒是和;
(6)若以NaOH溶液为标准液,通过滴定的方法测定另一未知浓度的HF溶液的浓度,推测最好使用的指示剂为(常见指示剂的变色范围是:甲基橙3.1~4.4,酚酞8~10).
【答案】
(1)4
(2)逐渐增大
(3)c(F﹣)>c(Na+)>c(HF)>c(H+)>c(OH﹣)
(4)=
(5)F﹣;HF
(6)酚酞
【解析】解:(1)0.1mol/L的氢氟酸溶液中有0.1%的HF发生电离,则c(H+)=0.1×0.1%=10﹣4mol/L,则pH=4;所以答案是:4;(2)酸抑制水的电离,氢离子浓度减小,则水的电离程度增大,滴加NaOH溶液至恰好反应的过程中,消耗氢离子,则氢离子浓度减小,所以水的电离程度逐渐增大;所以答案是:逐渐增大;(3)NaOH加入了10mL,溶液中溶质为等浓度的HF和NaF,溶液显酸性,则HF的电离程度大于F﹣的水解程度,而钠离子不水解,所以c(F﹣)>c(Na+)>c(HF)>c(H+)>c(OH﹣);所以答案是:c(F﹣)>c(Na+)>c(HF)>c(H+)>c(OH﹣);(4)溶液中电荷守恒为c(F﹣)+c(OH﹣)=c(Na+)+c(H+),pH=7,则c(OH﹣)=c(H+),所以c(F﹣)=c(Na+);所以答案是:=;(5)向20mL0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,NaOH加入了20mL,二者恰好反应生成NaF,其浓度为0.05mol/L,由于NaF部分水解生成HF,则由物料守恒可知,c(F﹣)+c(HF)=0.05mol/L;所以答案是:F﹣、HF;(6)NaOH与HF恰好反应生成NaF显碱性,选择在碱性条件下变色的指示剂,所以选择酚酞;所以答案是:酚酞.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分 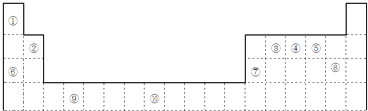
(1)元素⑩的次外层电子数为个.
(2)如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是;
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质.写出元素②的氢氧化物与NaOH溶液反应的离子方程式;
(4)根据下列五种元素的第一至第四电离能数据(单位:kJmol﹣1),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一主族的是 . (填元素代号)
②T元素最可能是(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列生成二氧化硫的反应中,反应物中的含硫物质被氧化的是( )
A.硫在空气中燃烧
B.铜片与浓硫酸共热
C.红热的木炭与浓硫酸反应
D.亚硫酸钠与较大浓度硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下面实验装置设计实验制备SO2并进行相关探究活动。
已知:酸性强弱:H2SO3>H2CO3>HClO
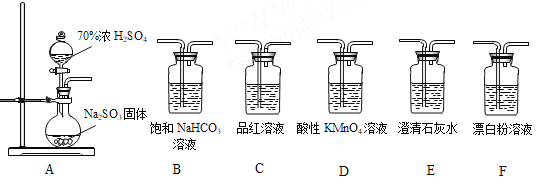
(1)装置A中反应的化学方程式为________________________________________。
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→( )→( ) →C→F。________
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。则C装置的作用是________________________,通过_______________________现象即可证明亚硫酸酸性强于碳酸。
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_______________。
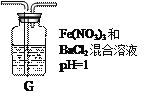
推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO![]() 氧化;
氧化;
原因二:SO2被Fe3+氧化;
原因三:________________________。
若是原因二,需证明Fe3+的还原产物,其实验操作及现象是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 单位体积溶液里所含的溶质的物质的量,叫做物质的量浓度
B. 气体摩尔体积就是22.4 L /mol
C. 摩尔质量就是微粒的相对分子质量或者相对原子质量
D. 物质的量就是物质的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乙烯、苯均能与H2发生加成反应,说明两者均含碳碳双键
B.相同质量的烃完全燃烧,耗氧量最大的是CH4
C.相同质量的乙炔、苯分别在足量氧气中燃烧,苯比乙炔消耗的氧气质量多
D.乙烯、氯乙烯、聚氯乙烯均能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为空气的成分。F的焰色反应是黄色。在G中,金属元素与非金属元素的原子个数比为2:1。在一定条件下,各物质之间的相互转化关系如图(反应条件及部分产物未列出):
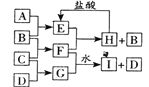
(1)A的元素符号是______________,F的电子式为________________________。
(2)E与F反应的化学方程式:_________________________________________。
(3)F与G的水溶液反应的离子方程式:______________________________。
(4)硫与热浓氢氧化钠溶液反应的离子方程式:__________________________。
(5)在加热条件下浓硝酸可把硫单质氧化到最高价产物,写出反应的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮气的说法中,错误的是( )
A.通常情况下,氮气性质比较稳定
B.氮气可经一步反应转化成二氧化氮
C.通常情况下,氮气在水中的溶解度很小
D.跟氢气在一定条件下发生反应时,氮气是氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com