
酸性 KMnO4 溶液能与草酸(H2C2O4)溶液反应。某化学探究小组利用反应过程中溶液紫色消失快慢的 方法来研究影响反应速率的因素。
I.实验前首先用浓度为 0.1000 mol/L 酸性 KMnO4 标准溶液滴定未知浓度的草酸溶液。
(1)写出滴定过程中发生反应的离子方程式 。
(2)下列有关一定物质的量浓度溶液配制的说法中正确的是 。
A.把 15.8 g KMnO4 固体溶于 1 L 水中所得溶液物质的量浓度为 0.1 mol/L
B.把 0.01 mol KMnO4 固体投入 100 mL 容量瓶中加水至刻度线,充分振荡后,浓度为 0.1 mol/L
C.需要 90 mL 0.1 mol/L 的 KMnO4 溶液,应准确称量 KMnO4 固体 1 58 g
D.定容时仰视容量瓶颈刻度线读数,会使配制的溶液浓度偏高
II.通过滴定实验得到草酸溶液的浓度为 0.2000 mol/L。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为 8.00 mL)。
实验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾 溶液 | |
体积(mL) | 浓度(mol/L) | |||
1 | 25 | 0.5 | 4.00 | 0.1000 |
2 | 50 | 0.5 | 4.00 | 0.1000 |
3 | 25 | 0.5 | 4.00 | 0.0100 |
4 | 25 | 0 | 4.00 | 0.1000 |
(3)写出表中实验 1 和实验 2 的实验目的: 。
(4)该小组同学对实验 1 和实验 3 分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验 编号 | 溶液褪色所需时间 (min) | ||
第 1 次 | 第 2 次 | 第 3 次 | |
1 | 14.0 | 13.0 | 11.0 |
2 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“其他条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,甲同学改进了实验方案,请简述甲同学改进 的实验方案______________。
(5)该实验中使用的催化剂应选择 MnSO4 并非 MnCl2,原因可用离子方程式表示为________。
III.工业上可用软锰矿(主要成分为 MnO2)经下列生产过程制备高锰酸钾。
①由软锰矿提取得到 MnO2,然后在 MnO2、KOH 的熔融混合物中通入空气可制得锰酸钾(K2MnO4);
②向锰酸钾溶液中通入CO2可获得高锰酸钾。
(6)第①步生产过程中,在熔融混合物中通入空气时发生反应的化学方程式:______________。
(7)向锰酸钾溶液中通入CO2可获得高锰酸钾,该反应中氧化产物与还原产物的物质的量之比为________________。
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源:2016-2017学年河北省高二上10月月考化学卷(解析版) 题型:选择题
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如右图所示,下列叙述中正确的是

A.每生成2分子AB吸收bkJ热量
B.该反应中反应物的总能量高于生成物的总能量
C.该反应焓变为ΔH=+(a-b) kJ/mol
D.断裂1molA-A键和1molB-B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次月考化学卷(解析版) 题型:选择题
下列家庭化学小实验不能达到预期目的是( )
A.用米汤检验食用加碘盐中含有碘
B.用醋、石灰水验证蛋壳中含有碳酸盐
C.用碘酒检验葡萄中是否含有淀粉
D.用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期10月月考化学试卷(解析版) 题型:选择题
用试剂制备下列气体和性质实验中,由现象得出的结论错误的是
选项 | 试剂 | 试纸或试液或气体 | 现象 | 结论 |
A | 浓氨水、生石灰 | 湿润的红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
B | 亚硫酸钠、浓硫酸 | 澄清石灰水溶液 | 溶液先变浑浊后又澄清 | 溶解度 |
C | 浓盐酸、MnO2加热 | 淀粉碘化钾试液 | 变蓝 | Cl2具有氧化性 |
D | 稀硝酸、铜 | 产生无色气体通入空气 | 气体变为 | 无色气体为NO |
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期10月阶段测化学卷(解析版) 题型:推断题
芳香烃 X 是一种重要的有机化工原料,其相对分子质量为 92,某课题小组以它为原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。已知:A 是一氯代物,H 是一种功能高分子,链节组成为 C7H5NO。

已知:

回答下列问题:
(1)对于阿司匹林,下列说法正确的是 。
A.是乙酸的同系物
B.能发生酯化反应
C.不能发生加成反应
D.1 mol 阿司匹林最多能消耗2 mol NaOH
(2)H 的结构简式是 ,F→G 的反应类型是 。
(3)写出 C→D 的化学方程式: 。
(4)写出符合下列条件的 的同分异构体的结构简式:____________(写出 2 种)。
的同分异构体的结构简式:____________(写出 2 种)。
①属于芳香族化合物,且能发生银镜反应
②核磁共振氢谱图中峰面积之比为 1∶2∶2∶1
③分子中有 2 个羟基
(5)阿司匹林与氢氧化钠溶液在加热条件下反应的化学方程式:_______________。
(6)以 A 为原料可合成 ,请设计合成路线,要求不超过 4 步(无机试剂任选)。 合成路线的书写格式参照如下示例流程图: 。
,请设计合成路线,要求不超过 4 步(无机试剂任选)。 合成路线的书写格式参照如下示例流程图: 。

查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期10月阶段测化学卷(解析版) 题型:选择题
下列装置合理且能达到实验目的的是
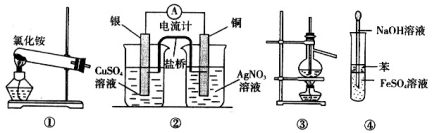
A.实验室用装置①制取氨气
B.装置②将化学能转化为电能
C.装置③可用于分离沸点相差较大的互溶液体混合物
D.装置④可用于 Fe(OH)2 的制取,并能防止 Fe(OH)2 被氧化
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上学期10月月考化学试卷(解析版) 题型:推断题
短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是____________(用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的电子式为____________;
(4)E的最高价氧化物的水化物的化学式为____________;
(5)单质C在空气中燃烧的产物存在的化学键类型为 ;其反应化学方程式为 ;
(6)单质E与水反应的离子方程式为____________.
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上月考二化学试卷(解析版) 题型:推断题
用乙烯、甲苯、E三种原料合成高分子药物M和有机中间体L的路线如下:

已知:
III.L是六元环酯,M的分子式是(C15H16O6)n。
回答下列问题:
(1) B中官能团的名称是________,D的结构简式是_________。
(2) E→F的反应条件是__________, H→J的反应类型是_________。
(3) F→G的化学反应方程式是_________。
(4)K→M属于加聚反应,M的结构简式是_________。
(5)碱性条件下,K水解的化学反应方程式是_________。
(6)符合下列条件的C的同分异构体的结构简式是_______。
①属于芳香族化合物;
②能发生银镜反应;
③核磁共振氢谱有4组峰,且峰面积之比为l:l:2:2。
查看答案和解析>>
科目:高中化学 来源:2017届河北邯郸市高三上学期第二次月考化学试卷(解析版) 题型:选择题
已知:2Zn(s)+O2(g)=2ZnO(s);△H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s);△H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为( )
A.+519.4kJ·mol-1 B.-259.7kJ·mol-1 C.+259.7 kJ·mol-1 D.-519.4kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com