
| A. | 将得到的m g固体放到氧气中充分灼烧后,固体质量变为4.8 g | |
| B. | 生成的CO2已被Ba(OH)2溶液完全吸收,Ba2+沉淀完全 | |
| C. | Ba(OH)2溶液吸收CO2后的溶液中有BaCO3和Ba(HCO3)2,且物质的量的比为2:1 | |
| D. | 原混合物中CuO与Fe2O3的质量比为2:1 |
分析 CuO、Fe2O3混合物跟足量CO充分反应生成Cu、Fe单质及CO2,反应后生成3.52g气体为二氧化碳,物质的量为:$\frac{3.52g}{44g/mol}$=0.08mol,金属氧化物中的氧元素的物质的量与二氧化碳的物质的量相等,则原混合物中含有氧原子的物质的量为0.8mol,设混合物中CuO、Fe2O3的物质的量分别为xmol、ymol,则:x+3y=0.8mol、80x+160y=4.8,联立解得:x=0.02、y=0.02,故原混合物中CuO与Fe2O3物质的量的都为0.02mol;
CuO、Fe2O3混合物跟足量CO充分反应;
n[Ba(OH)2]=0.6mol/L×0.1L=0.06mol,故n(CO2):n[Ba(OH)2]=0.08mol:0.06mol=4:3,介于1:1与2:1之间,故生成碳酸钡与碳酸氢钡;设出碳酸钡与碳酸氢钡物质的量分别为amol、bmol,根据钡离子守恒、碳元素守恒列方程计算,据此进行解答.
解答 解:CuO、Fe2O3混合物跟足量CO充分反应生成Cu、Fe单质及CO2,反应后生成3.52g气体为二氧化碳,物质的量为:$\frac{3.52g}{44g/mol}$=0.08mol,金属氧化物中的氧元素的物质的量与二氧化碳的物质的量相等,则原混合物中含有氧原子的物质的量为0.8mol,设混合物中CuO、Fe2O3的物质的量分别为xmol、ymol,则:x+3y=0.8mol、80x+160y=4.8,联立解得:x=0.02、y=0.02,故原混合物中CuO与Fe2O3物质的量的都为0.02mol,
A.将得到的m g固体放到氧气中充分灼烧后得到的产物为CuO、Fe3O4,所得固体的质量增大,故A错误;
B.n[Ba(OH)2]=0.6mol/L×0.1L=0.06mol,故n(CO2):n[Ba(OH)2]=0.08mol:0.06mol=4:3,介于1:1与2:1之间,故生成碳酸钡与碳酸氢钡,故B错误;
C.根据B可知,氢氧化钡与二氧化碳反应生成了碳酸钡和碳酸氢钡的混合物,碳酸钡与碳酸氢钡物质的量分别为amol、bmol,根据钡离子守恒、碳元素守恒可得:a+2b=0.08、a+b=0.06,解得:a=0.04、b=0.02,则生成碳酸钡与碳酸氢钡的物质的量之比为0.04mol:0.02mol=2:1,故C正确;
D.原混合物中CuO、Fe2O3的质量之比为80g/mol×0.02mol:160g/mol×0.02mol=1:2,故D错误;
故选C.
点评 本题考查混合物的有关计算,题目难度中等,明确反应反应的实质为解答关键,利用守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
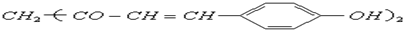 ,用它制成的试纸可以检验溶液的酸碱性.能够跟1mol该化合物起反应的Br2水溶液或H2的最大用量分别是( )
,用它制成的试纸可以检验溶液的酸碱性.能够跟1mol该化合物起反应的Br2水溶液或H2的最大用量分别是( )| A. | 3mol 3mol | B. | 3mol 5mol | C. | 6 mol 10 mol | D. | 6 mol 8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | V | |||
| X | W |
| A. | 原子半径:X>W>V>Y | |
| B. | Y的最高价氧化物的电子式为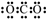 | |
| C. | X的最高价氧化物能与V、W最高价氧化物对应的水化物反应 | |
| D. | 甲、乙混合时所生成的物质为离子化合物,既含有离子键又含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
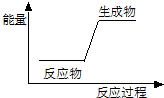
| A. | 生石灰和水的反应 | B. | 木炭在氧气中燃烧 | ||
| C. | 石灰石在高温下的分解反应 | D. | 盐酸与氢氧化钠溶液的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某气体通入FeCl2溶液中 | 溶液由浅绿色变为黄色 | 该气体中一定含有Cl2 |
| B | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体中一定含有SO2 |
| C | 将某气体通过灼热的CuO粉末 | 粉末由黑变红 | 该气体中一定含有H2 |
| D | 将某气体与湿润的红色石蕊试纸接触 | 试纸变蓝色 | 该气体中一定含有NH3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | KClO3在反应中得到电子 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1 mol KClO3参加反应,有2 mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com