
| A. |  :3-甲基-2-戊烯 :3-甲基-2-戊烯 | B. | 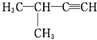 :2-甲基-3-丁炔 :2-甲基-3-丁炔 | ||
| C. | 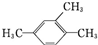 :1,3,4-三甲苯 :1,3,4-三甲苯 | D. | 2,3-二甲基-2-乙基己烷 |
分析 有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
1)命名要符合“一长、一近、一多、一小”,也就是主链最长,编号起点离支链最近,支链数目要多,支链位置号码之和最小;
2)有机物的名称书写要规范;
3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A.符合命名规则,故A正确;
B.从离三键近的一端开始编号,依据系统命名法得到名称为3-甲基-1-丁炔,故B错误;
C.取代基位次和不是最小;依据系统命名法得到名称为:1,2,4-三甲苯,故C错误;
D.主链不是最长,名称为3,3-二甲基-4-乙基庚烷,故D错误.
故选A.
点评 本题考查了有机物的命名,为高考考查的重点和难点,题目难度不大,试题侧重对学生基础知识的检验和训练,解答关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.


科目:高中化学 来源: 题型:解答题
 氮族元素和硼族元素在生产生活中有很重要的地位.
氮族元素和硼族元素在生产生活中有很重要的地位.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | CH3COOH 溶液加水稀释后,溶液中C(OH-)减小 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2Cl$→_{H_{2}O}^{NaOH}$CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| B. | CH3CH2Cl$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Cl$→_{醇}^{NaOH}$CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Cl$→_{醇}^{NaOH}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2晶体和SiO2晶体中,微粒之间的化学键类型相同,晶体类型也相同 | |
| B. | H2S分子中,所有原子的最外层都达到了8电子的稳定结构 | |
| C. | 碘单质升华过程中不存在化学键被破坏的过程 | |
| D. | NaCl气体溶于水后,因为共价键被破坏,从而形成了Na+和Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


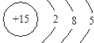 、其最高价氧化物对应的水化物的化学式H3PO4.
、其最高价氧化物对应的水化物的化学式H3PO4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com