
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 反应①中的能量变化如图所示: | |
| C. | 根据②推知反应CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ/mol | |
| D. | CH3OH转变成H2的过程一定要吸收能量 |
分析 A、燃烧热是指完全燃烧1mol物质生成最稳定的产物的过程所放出的热量;
B、反应物的能量高于生成物的能量,则反应是放热的过程;
C、气体甲醇变为液态甲醇的过程是放热的过程;
D、根据化学反应焓变的意义以及反应能量变化和反应物、产物能量的关系来回答判断.
解答 解:A、燃烧热是指完全燃烧1mol物质生成最稳定的产物的过程放出的热量,甲醇燃烧对应产物应该是二氧化碳气体和液态的水,不是氢气,故A错误;
B、根据图显示内容知道:反应物的能量高于生成物的能量,则反应是放热的过程,而①反应焓变大于0,是吸热的过程,故B错误;
C、气体甲醇变为液态甲醇的过程是放热的过程,根据反应②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ•mol-1 知道,液态甲醇发生此反应放出的热量会小于192.9kJ,故C正确;
D、根据化学方程式②知道,甲醇转化为氢气的过程就是放热的,故D错误;
故选C.
点评 本题考查学生物质具有的能量和化学反应的吸放热之间的关系,注意知识的归纳和整理是解题的关键,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
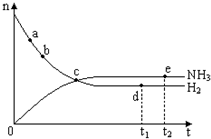 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点 c处反应达到平衡 | |
| C. | 点d(t1时刻) 和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,573K下反应至t1时刻,n(H2)比图中d点的值大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (氧化剂)
(氧化剂)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫离子的结构示意图: | |
| B. | 原子核内有10个中子的氧离子:${\;}_{8}^{18}$O | |
| C. | NH4Cl的电子式: | |
| D. | 乙烯的结构简式C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH | B. | CuSO4 | C. | K2SO4 | D. | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把锌粉改为锌粒 | B. | 水 | ||
| C. | 碳酸钠(固体) | D. | 降低反应体系温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | |
| D | E | F |
 ,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com