
| A. | 达到化学平衡时,5v正(O2)=4v逆(NO) | |
| B. | 若单位时间内生成x mol NO,同时消耗x mol NH3,则可确定反应达到平衡状态 | |
| C. | 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率也减小 | |
| D. | 化学反应速率的关系是2v正(NH3)=3v正(H2O) |
分析 当达到化学平衡时,正逆反应速率相等,各物质的浓度、百分含量不变,增大容器的气体,浓度减小,正逆反应速率都减小,以此解答该题.
解答 解:A.反应达到平衡状态时,正逆反应速率相等,4V正(O2)=5V逆(NO),说明消耗氧气的速率和生成氧气的速率相等,故A错误;
B.无论是否达到平衡状态,反应速率之比都等于化学计量数之比,即位时间内生成xmolNO的同时,消耗xmolNH3,但不能说明正逆反应速率相等,故B错误;
C.增大容器的体积,浓度减小,则正反应速率减小,逆反应速率也减小,故C正确;
D.反应速率之比等于化学计量数之比,则3V正(NH3)=2V正(H2O),故D错误.
故选C.
点评 本题综合考查化学平衡的影响因素以及化学平衡状态的判断,为高频考点,题目难度中等,注意用不同物质的表示的正逆反应速率相等的表达方法,此为易错点.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2O2含有的共价键数为0.2NA | |
| B. | 7.8gNa2S与Na2O2的混合物,含离子总数为0.3NA | |
| C. | 标准状况下,22.4L溴单质含有NA个溴分子 | |
| D. | 0.2 molNa被完全氧化生成7.8gNa2O2,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳的燃烧热大于110.5 kJ/mol | |
| B. | ①反应的焓变为-221 kJ/mol | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Ba2+ | C. | Cl- | D. | Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 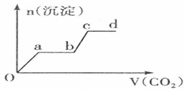 | B. | 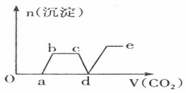 | ||
| C. | 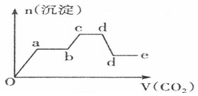 | D. | 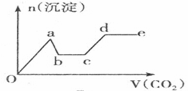 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
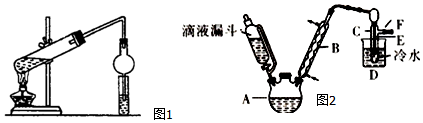
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com