
(12分)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O(g) CO(g) + 3H2(g) △H=+206.0kJ·mol-1
CO(g) + 3H2(g) △H=+206.0kJ·mol-1
II:CO(g) + 2H2(g) CH3OH(g) △H=-129.0kJ·mol-1
CH3OH(g) △H=-129.0kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为:
。
(2)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如下图。

①假设100 ℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1MPa、温度为300℃条件下,将amol CO与3amol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是
(填字母序号)。
A c(H2)减少 B 正反应速率加快,逆反应速率减慢
C CH3OH 的物质的量增加 D 重新平衡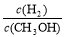 减小
减小
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:

①写出阳极电极反应式 。
②写出除去甲醇的离子方程式 。
(1)CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ?mol-1(2分)
(2)①0.03 mol?L-1?min-1(2分)②2.25×10-4(2分)
(3)C、D(各1分,共2分)
(4)①Co2+—e-=Co3+(2分)
②6Co3++CH3OH+H2O=CO2↑+6Co2++6H+(2分)
【解析】
试题分析:(1)I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ?mol-1
II:CO(g)+2H2 (g)=CH3OH (g)△H=-129.0kJ?mol-1
依据盖斯定律,Ⅰ+Ⅱ得到:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ?mol-1
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=1.5mol÷100L÷5min=0.03 mol?L-1?min-1。
②100℃时反应I的平衡浓度为c(CH4)=0.050mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,平衡常数K=0.005×0.0153÷(0.005×0.015)=2.25×10-4。
(3)A.平衡后将容器的容积压缩到原来的1/2,压强增大,平衡向正反应方向移动,生成物的浓度增大,由于平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,故A错误;B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误;C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确;D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡 减小,故D正确;E.平衡常数只受温度影响,温度不变,平衡常数不变,故E错误。
减小,故D正确;E.平衡常数只受温度影响,温度不变,平衡常数不变,故E错误。
(4)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+。
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
考点:本题考查热化学方程式、化学平衡图象、影响化学平衡因素、平衡常数与反应速率计算、原电池。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015届广东省湛江市高一第一学期期中考试化学试卷(解析版) 题型:实验题
(16分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其反应的化学方程式为 。
(2)工业上常用氯气与熟石灰反应制漂白粉,漂白粉的有效成分为 (填化学式)。
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是 。
(4)反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是 (填写编号字母);
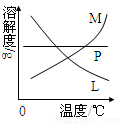
从②的试管中分离出该晶体的方法是 (填写实验操作名称)。
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性 。为什么? 。
(6)若②的试管溶液中不但有KClO3生成还有KClO生成,且二者的物质的量之比为1∶2,则该反应中氧化剂和还原剂的物质的量之比为: 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:选择题
工业上铁的冶炼是在炼铁高炉中进行的,发生的反应是 Fe2O3+3CO=2Fe+3CO2,此反应属于
A、化合反应 B、氧化还原反应 C、置换反应 D、分解反应
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连
B.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C.一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0
D.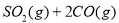

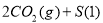 达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高
达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
下列有关物质应用的说法不正确的是
A.氯气用于制备漂白粉
B.单质硅用于制造光导纤维
C.氧化铝的熔点很高,可用于制作耐高温材料
D.三氧化二铁用于生产红色颜料
查看答案和解析>>
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:选择题
一定条件下存在反应:2SO2(g) + O2(g) 2SO3(g),ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

A.容器I、Ⅲ中平衡常数相同
B.容器II、Ⅲ中正反应速率相同
C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:II>III
D.容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:选择题
强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:
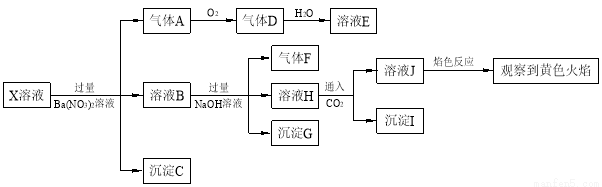
下列结论正确的是
A.X中肯定存在Na+、Fe2+、A13+、NH4+、SO42-
B.气体F经催化氧化可直接生成气体D
C.沉淀C一定是BaSO4、 沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3
D.X中不能确定的离子是 A13+、Na+、K+和C1-
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:选择题
反应A(g)+2B(g)===C(g)的反应过程中能量变化如下图所示。下列相关说法正确的是
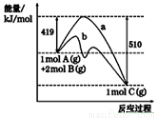
A.正反应活化能大于逆反应活化能
B.曲线b表示使用催化剂后的能量变化
C.由图可知该反应的焓变ΔH=+ 91 kJ·mol-1
D.反应中将气体A换为固体反应,其他条件不变,反应放出热量小于91kJ
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次阶段性检测化学试卷(解析版) 题型:选择题
在含有FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的NaOH溶液,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目减少的是
A.Na+ B.Fe3+ C.Al3+ D.Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com