
分析 (1)溶液①为0.1mol/L NH4Cl,而NH4Cl是强酸弱碱盐,水解显酸性,据此分析;
(2)①0.1mol/L NH4Cl中NH4+发生单水解显酸性; ②0.1mol/L CH3COONH4中NH4+和CH3COO-发生双水解显中性; ③0.1mol/L NH4HSO4中能完全电离出H+;
④0.1mol/L NH3•H2O和0.1mol/L NH4Cl混合液中NH3•H2O的电离程度大于NH4Cl的水解程度,溶液显碱性; ⑤0.1mol/L NH3•H2O是弱电解质,发生微弱的电离显碱性;
盐类的水解对水的电离有促进作用,酸或碱对水的电离有抑制作用,且酸性或碱性越强,对水的电离的抑制越强,据此分析.
(3)②CH3COONH4中NH4+和CH3COO-发生双水解; ③NH4HSO4中NH4+的水解被H+抑制;
(4)在溶液④中,NH3•H2O发生电离,而NH4+发生水解,但Cl-不发生改变;根据物料守恒来分析;
(5)由于NH3•H2O是弱电解质,在加水稀释时,电离平衡被促进,据此分析c(OH-)的变化.
解答 解:(1)溶液①为0.1mol/L NH4Cl,而NH4Cl是强酸弱碱盐,水解显酸性:NH4++H2O?NH3•H2O+OH-,故答案为:酸,NH4++H2O?NH3•H2O+OH-;
(2)①0.1mol/L NH4Cl中NH4+发生单水解显酸性,由于盐的单水解程度很小,故溶液的酸性很弱;
②0.1mol/L CH3COONH4中NH4+和CH3COO-发生双水解显中性;
③0.1mol/L NH4HSO4中能完全电离出H+,故溶液中的氢离子的浓度为0.1mol/L,溶液显强酸性;
④0.1mol/L NH3•H2O和0.1mol/L NH4Cl混合液中NH3•H2O的电离程度大于NH4Cl的水解程度,溶液显碱性;
⑤0.1mol/L NH3•H2O是弱电解质,发生微弱的电离而显碱性;
故溶液pH最小的是③;
盐类的水解对水的电离有促进作用,酸或碱对水的电离有抑制作用,故①②中水的电离程度均大于③④⑤中水的电离程度,溶液中酸和碱的酸性或碱性越强,对水的电离的抑制越强,水的电离程度越小,而在③④⑤中,③的溶液显强酸性,而④⑤只显弱碱性,故③中水的电离程度最小、由水电离出c(H+)最小,故答案为:③,③;
(3)②CH3COONH4中NH4+和CH3COO-发生双水解,NH4+的水解被促进,水解程度变大,c(NH4+)减小的程度大;而 ③NH4HSO4中NH4+的水解被H+抑制,c(NH4+)减小的程度小,故溶液②、③中c(NH4+)的大小关系是②<③,故答案为:<;
(4)在溶液④中,NH3•H2O发生电离,而NH4+发生水解,但Cl-不发生改变,故Cl-离子的浓度为0.1mol/L;在溶液④中,NH3•H2O发生电离:NH3•H2O?NH4++OH-,部分电离为NH4+,而NH4+发生水解:NH4++H2O?NH3•H2O+H+,部分水解为NH3•H2O,根据物料守恒可知,NH3•H2O和NH4+离子的物质的量浓度之和为0.2mol/L,故答案为:Cl-,NH4+;
(5)由于NH3•H2O是弱电解质,在加水稀释时,电离平衡被促进,故溶液中c(OH-)大于原来的$\frac{1}{10}$,故答案为:大于.
点评 本题考查了盐溶液中的水解平衡和弱电解质的电离平衡,虽然综合性较强,但难度不大,注意水解和电离程度受外界条件的影响.


科目:高中化学 来源: 题型:解答题
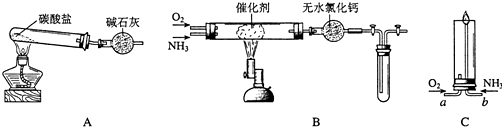
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Na+、Cl-、NO${\;}_{3}^{-}$ | B. | H+、Na+、Cl-、CO32- | ||
| C. | Na+、Ag+、Cl-、OH- | D. | Na+、Ca2+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
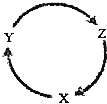 下列各组物质中,不能满足如图物质一步转化关系的选项是( )
下列各组物质中,不能满足如图物质一步转化关系的选项是( ) | 选项 | X | Y | Z |
| A | Fe | FeCl3 | FeCl2 |
| B | Al(OH)3 | AlCl3 | Al2O3 |
| C | SiO2 | Na2SiO3 | H2SiO3 |
| D | NH3 | NH4Cl | NH4NO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH溶液和明矾的水溶液 | B. | Na2CO3溶液和HCl溶液 | ||
| C. | NaHCO3溶液和HCl溶液 | D. | 盐酸和NaAlO2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com