
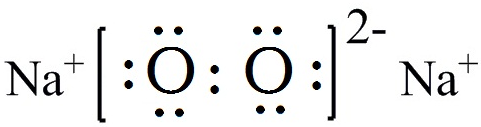 .
.分析 (1)为离子化合物,含钠离子和过氧根离子;
(2)氢气在高温下与四氯化硅反应提纯粗硅,还生成HCl;
(3)AgCl沉淀中加入氨水,白色沉淀逐渐消失,生成银氨溶液;
(4)Cr元素的化合价由+6价降低为+3价,C元素的化合价由-2价升高为0,结合电子、电荷守恒配平.
解答 解:(1)Na2O2的电子式为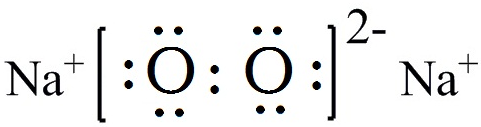 ,
,
故答案为: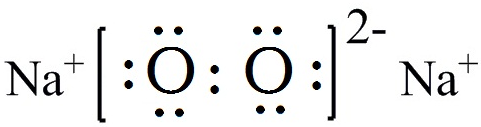 ;
;
(2)氢气在高温下与四氯化硅反应提纯粗硅,还生成HCl,反应为SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl,故答案为:SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl;
(3)AgCl沉淀中加入氨水,白色沉淀逐渐消失,生成银氨溶液,离子反应为AgCl+2NH3•H2O=Ag( NH3)2++Cl-+2H2O,故答案为:AgCl+2NH3•H2O=Ag( NH3)2++Cl-+2H2O;
(4)Cr元素的化合价由+6价降低为+3价,C元素的化合价由-2价升高为0,由电子、电荷守恒可知离子反应为2Cr2O72-+3CH3CH2OH+16H+=4Cr3++3CH3COOH+11H2O,
故答案为:2;3;16H+;4;3;11H2O.
点评 本题考查氧化还原反应及离子反应,为高频考点,把握离子反应方程式的书写、化合价变化等为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
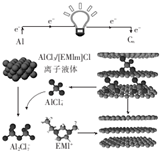 英国《自然》杂质近期报道了一种用泡沫石墨烯(CW)作为正极材料的新型铝离子电池,其放电时的工作原理如图所示,下列说法不正确的是( )
英国《自然》杂质近期报道了一种用泡沫石墨烯(CW)作为正极材料的新型铝离子电池,其放电时的工作原理如图所示,下列说法不正确的是( )| A. | 放电时,若外电路中转移1mol电子,则负极质量减少9g | |
| B. | 充电时,石墨烯作阳极 | |
| C. | 充电时,阴极的电极反应式为AlCl4-+3e-═Al+4Cl- | |
| D. | 放电时,正极的电极反应式为CW(AlCl4)+e-═CW+AlCl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下,1L pH=8的纯水中含OH-为10 -6mol | |
| B. | 电解精炼铜过程中,阳极质量的减少值与阴极质量的增加值一定相等 | |
| C. | 合成氨的反应是放热反应,则采用低温条件可以提高氨的生成速率 | |
| D. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
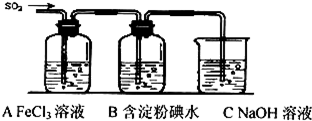
| A. |  制取并收集少量HCl | B. | 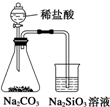 证明非金属性强弱:Cl>C>Si | ||
| C. | 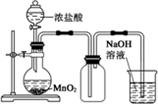 实验室制Cl2 | D. | 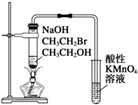 验证溴乙烷发生消去反应生成烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子数 | B. | 中子数 | C. | 质子数 | D. | 原子序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
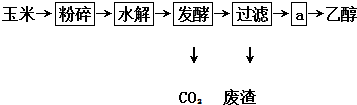
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com