
 根据如图所提供的信息,在反应一段时间后:
根据如图所提供的信息,在反应一段时间后:
| ||
| ||


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
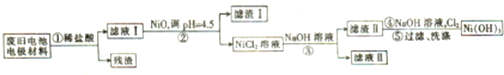
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、步骤3的操作名称是过滤 |
| B、步骤1所需玻璃仪器是烧杯和玻璃棒 |
| C、试剂A是BaCl2溶液 |
| D、加入试剂A 的目的是除去CO32-并避免对Cl-或OH-的检验的干扰 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置①中,电池反应为Zn+Cu2+═Zn2++Cu |
| B、装置②工作一段时间后,a极附近溶液的pH增大 |
| C、用装置③精炼铜时,d极为粗铜 |
| D、装置④中电子由Zn流向Fe,Na+、H+移向Zn电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
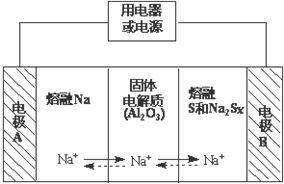 钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食物的酸碱性是按食物在体内代谢最终产物的性质来分类的 |
| B、酸性食物在体内代谢后可形成阴离子酸根 |
| C、碱性食物在体内代谢后可形成含金属阳离子的碱性物质 |
| D、某些水果酸味很强,它们是酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将CO2通入BaCl2溶液中至饱和,有沉淀产生 |
| B、在NaHCO3溶液中,加入澄清石灰水,有白色沉淀生成 |
| C、向AlCl3溶液中滴加浓氨水,产生白色沉淀;再加入过量浓氨水,沉淀仍不消失 |
| D、向FeCl2溶液中滴入KSCN溶液没有现象,再滴入氯水溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | NH4+ | Na+ | Cl- | NO3- | SO42- |
| 浓度(mol/L) | 2.0×10-5 | 1.9×10-5 | 6.0×10-5 | 2.3×10-5 | 2.8×10-5 |
| A、3 | B、4 | C、5 | D、6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com