
 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.  优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3中滴加Na2SO3溶液:2H++SO32-═SO2↑+H2O | |
| B. | 向Al2(SO4)3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| C. | 向0.1mol/L pH=1的KHA溶液中加入KOH溶液:H++OH-═H2O | |
| D. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 反应条件 | 时间 | NO/mol | Cl2/mol | NOCl/mol |
| 实验① | T、恒容 | 初始 | 0.2 | 0.1 | 0 |
| 10 min | 0.05 | 0.025 | |||
| 12 min | 0.15 | ||||
| 实验② | T、恒压 | 初始 | 0.2 | 0.1 | 0 |
| A. | 实验①中,0~10min内,v(NOCl)=7.5×10-3 mol•L-1•min-1 | |
| B. | 平衡时若升高温度,达到新平衡时K=400,则该反应△H>0 | |
| C. | 平衡时实验②比实验①的Cl2转化率大 | |
| D. | 若实验①起始只充入0.4molNOCl,则平衡时NOCl浓度大于0.15mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
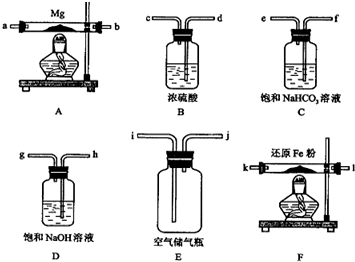
| 装置 | 目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时c(NH3)=5mol/L | |
| B. | 平衡时HI分解率为20% | |
| C. | 混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志 | |
| D. | 平衡后缩小容器体积,NH4I的物质的量增加,I2的物质的量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com