
【题目】人们对苯的认识有一个不断深化的过程。已知分子式为 C6H6的结构有多种,其中的两种为:
Ⅰ.![]() Ⅱ.
Ⅱ.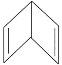
(1)这两种结构的化学性质区别表现在:Ⅰ能________(填字母,下同),而Ⅱ能________。
A.被酸性KMnO4溶液氧化
B.与溴水发生加成反应
C.与氢气发生加成反应
(2)1 mol C6H6与H2发生完全加成反应,Ⅰ需________molH2,而Ⅱ需________mol H2。
(3)今发现C6H6还可能有另一种如下图所示的立体结构,该结构的二氯代物有_________种。
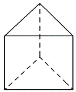
【答案】C ABC 3 2 3
【解析】
(1)Ⅱ含有碳碳双键,苯没有碳碳双键,Ⅱ能与溴水发生加成反应,能被酸性高锰酸钾溶液氧化,而苯不能,苯环在催化剂加热条件下可与氢气发生加成反应;
(2)1mol苯与3mol氢气发生加成反应,而1molⅡ含有2mol碳碳双键,能与2mol氢气发生加成反应;
(3)根据对称性原则、有序性原则即可确定其二氯代物的结构。
(1)Ⅱ含有碳碳双键,苯没有碳碳双键,Ⅱ能与溴水发生加成反应,能被酸性高锰酸钾溶液氧化,而苯不能,苯和Ⅱ都能与氢气发生加成反应,
故答案为: C ; ABC ;
(2)1mol 苯与 3mol 氢气发生加成反应,而 1mol Ⅱ含有 2mol 碳碳双键,能与 2mol 氢气发生加成反应;
故答案为: 3 ; 2 ;
(3) 两个Cl分别在上个面、侧面(相邻、相对),则该结构的二氯代物有3种,
故答案为: 3。


科目:高中化学 来源: 题型:
【题目】根据化学能和热能、电能相关的知识,请回答下列问题:
I.已知31 g白磷(P4)变为31 g红磷(P)时释放能量。上述变化属于_____变化;稳定性白磷_____红磷(填“>”或“<”);
II.氢气是一种清洁能源,在我国航天工程中也有应用。
(1)已知:2H2+O2![]() 2H2O。该反应1g氢气完全燃烧放出热量121kJ,其中断裂1molH—H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH—O键放出热量_______________。
2H2O。该反应1g氢气完全燃烧放出热量121kJ,其中断裂1molH—H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH—O键放出热量_______________。
(2)航天技术上使用的氢-氧燃料电池原理可以简单看作下图“氢-氧燃料电池的装置图” 则:

①a极为电池的______(填“正极”或“负极”);溶液中OH-移向_______电极(填“a”或“b”)。
②b电极附近pH_______。(填增大、减小或不变)。
③如把H2改为甲烷,则电极反应式为:负极_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温(500K)、体积为2.0L 的密闭容器中通入1.0 mol N2和1 mol H2发生合成氨反应,20 min 后达到平衡,测得反应放出的热量为 18.4 kJ,混合气体的总物质的量为 1.6 mol。
(1)从开始反应至达到平衡时,用NH3表示该反应的化学反应速率V(NH3)=__________。
(2)该反应的热化学方程式为_____________________________________________。
(3)若拆开1 mol H—H键和1 mol N![]() N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
(4)判断该反应达到平衡状态的依据是____________(填序号)。
①单位时间内消耗1mol N2 的同时消耗了3mol H2 ;
②单位时间内断裂1mol N≡N 的同时断裂了6mol N–H;
③V正(N2)=V逆(NH3);
④NH3的物质的量分数不再随时间而变化
⑤容器内气体的压强不再随时间而变化的状态 ;
⑥容器内气体的密度不再随时间而变化的状态;
⑦c(N2):c(H2):c(NH3)=1:3:2 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是A、B、C.D、E、F等几种常见有机物之间的转化关系图,其中A是面粉的主要成分;C和E反应能生成F,F具有香味,B与E的实验式相同。
![]()
根据以上信息及各物质的转化关系完成下列各题:
(1)B的化学式为____________, C中所含官能团名称__________, 与B同分异构体的一种物质的名称_____________。
(2)其中能与新制氢氧化铜悬浊液在加热煮沸条件下能产生砖红色的沉定的物质有_______(填名称)
(3)写出C→D的化学方程式___________________________________________
(4)写出C+E→F的化学方程式_________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法的是
A.合金具有优良性能,可用于制造新型金属材料
B.氧化铁俗称铁红,可用作红色油漆和外墙涂料
C.二氧化硫具有漂白性,常用来漂白食品
D.A12O3可用作耐高温材料,A1(OH)3可用于中和过多的胃酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下图像与相对应的反应情况分析正确的是
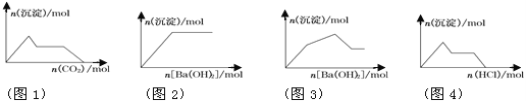
A. 图1:向含KOH和Ca(OH)2的混合溶液中缓慢通入CO2
B. 图2:向NaHSO4溶液中逐滴加入Ba(OH)2溶液
C. 图3:向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
D. 图4:向Na[Al(OH)4]溶液中逐滴加入盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以浓缩海水为原料提取溴的部分流程如右图:下列说法正确的是
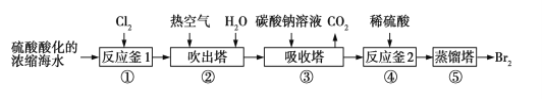
A. 海水需要浓缩,是因为海水中的Br2含量较低
B. 热空气的作用是将多余的Cl2吹出
C. 吸收塔中发生的反应是3Br2+3CO32-=5Br-+BrO3-+3CO2↑
D. 反应釜2中发生的反应是5Br-+BrO3-+3H2O=3Br2+6OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨是利用氮气和氢气在一定条件下反应生成的。氨是重要的工业原料。请回答下列问题:
(1)氮元素在周期表中的位置是第_______周期第_______族;氮原子结构示意图为________________;
(2)写出氨分子的电子式______;指出分子中化学键是_____(填‘离子键’或‘共价键’)。
(3)写成合成氨的化学方程式:________________________;该反应是放热反应,则相同条件下“1molN2和3molH2”的能量与“2molNH3”的能量较高的是________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com