
【题目】设NA为阿伏加德罗常数的值。关于常温下pH=2的H2C2O4溶液,下列说法正确的是( )
A. 1L溶液中的H+数目为0.02NA
B. 加入NaHC2O4固体,溶液酸性增强
C. c(H+)-c(OH-)=c(HC2O4-)+2c(C2O42-)
D. 加水稀释,溶液中所有离子浓度均减小
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为:

下列说法不正确的是
A. 上述反应为氧化还原反应 B. 滴定时可用淀粉溶液作指示剂
C. 滴定时应剧烈振荡锥形瓶使反应充分 D. 脱氢维生素C的分子式为C6H6O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:H2SO4>![]() >H2CO3>
>H2CO3>![]() > HCO3—,综合考虑反应物的转化率和原料成本等因素,将
> HCO3—,综合考虑反应物的转化率和原料成本等因素,将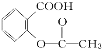 转变为
转变为![]() 的方法有
的方法有
A. 与足量的NaOH溶液共热后,再加入适量H2SO4
B. 与足量的NaOH溶液共热后,再通入足量CO2
C. 与稀H2SO4共热后,加入足量的NaHCO3溶液
D. 与稀H2SO4共热后,加入足量的Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计的制取溴苯的实验装置如下图所示:

装置A是酸式滴定管,分液漏斗中是苯和液溴的混合物,打开分液漏斗的活塞,使混合物滴在铁丝上(酸式滴定管活塞关闭)。请回答下列问题:
(1)A选用酸式滴定管而不用碱式滴定管的原因是___________________。
(2)A中反应的化学方程式是________________。
(3)垂直于A的导气管要做得长一些,是为了_________________。
(4)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是______________,反应的化学方程式是___________________。
(5)C中盛放四氯化碳的作用是_______________。
(6)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入硝酸银溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_____________,现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究氯、溴、硫的非金属性强弱,设计如下实验装置(加热及夹持装置已略)。

(1)仪器a的名称是______。试剂X是_____________。
(2)写出装置A中发生反应的化学方程式:__________________________________
(3)装置E中NaOH溶液的作用是____________________________________________
(4)反应一段时间后,观察到装置C中溶液变为橙黄色,说明非金属性:Cl___Br( 填“>"或"<")。
(5)打开装置C中的活塞,将装置C中的溶液逐渐滴人装置D中,振荡。观察到的现象是______________,写出可能发生反应的离子方程式:_____________________________________写一个即可),根据此现象不一定能说明溴的非金属性比硫强,原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含有Na2O杂质的Na2O2试样,一个化学实验小组利用H2O与Na2O2的反应来测定该样品的纯度。可供选择的装置如下:

请回答下列问题:
(1)装置⑤中仪器a的名称是______。
(2)用上述装置可以组装一套最简单的测定过氧化钠样品纯度的实验装置。
Ⅰ.该实验装置的组合是________(填字母)。
a. ①④⑤ b. ①③⑤ c. ②④⑤ d. ③⑤⑥
Ⅱ.所选用装置的连接顺序应是__________(填各接口的字母,连接胶管省略)。
(3)写出实验中Na2O2发生反应的化学方程式_____________。
(4)用上述实验后所得溶液配制成浓度为1.0mol/L的溶液,回答下列问题。
①向400mL该溶液中通入0.3mol CO2,则所得溶液中HCO3–和CO32–的物质的量浓度之比约为___________。
A. 1:3 B. 1:2 C. 2:1 D. 3:1
②将上述溶液蒸发结晶得到Na2CO3和NaHCO3固体混合物,下列选项中不能准确测定混合物中Na2CO3质量分数的是____________。
a. 取a g混合物充分加热,在干燥器中冷却至室温,减重b g
b. 取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体
c. 取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g
d. 取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号。请参照元素A~I在周期表中的位置,回答下列问题。
1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 | |
1 | A | |||||||
2 | B | C | D | E | ||||
3 | F | G | H | I |
(1)B、C两元素中非金属性较强的是________(写出元素名称),I元素在周期表中的位置是__________。
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式_________。
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1∶1和1∶2的两种共价化合物X和Y,请写出Y的电子式_________,该元素还能与A~I中的另一种元素以原子个数之比为1∶1和1∶2形成两种离子化合物Z和M,用电子式表示M的形成过程:____。
(4)表中某两种元素的气态单质可以形成燃料电池,其产物清洁无污染,请写出碱性环境中负极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A. 该硫酸的物质的量浓度为9.2mo1/L
B. 该硫酸与等体积的水混合所得溶液的质量分数为49%
C. 配制250mL 4.6mo1/L的稀硫酸需取该硫酸62.5mL
D. 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mo1/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳整理是科学学习的重要方法之一。氧族元素的各种性质可归纳整理为如下表所示的表格(部分)。
8O | 16S | 34Se | 52Te | |
单质熔点(℃) | -218.4 | 113 | 450 | |
单质沸点(℃) | -183 | 444.6 | 685 | 989 |
主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
原子半径 | 逐渐增大 | |||
单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据表回答下列问题:
(1)硒的熔点范围可能是___________。
(2)碲的化合价可能有__________。
(3)氢硒酸有较强的________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生反应的化学方程式为_______________。
(4)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:______Al2Te3+______=____Al(OH)3+______H2Te↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com