
【题目】我们通过电视画面经常可以看到在奥运会等各种激烈的比赛过程中,当运动员肌肉挫伤或扭伤时,医生随即对运动员的伤部喷射一种液体药剂来急救。该液体药剂为氯乙烷(沸点12.27 ℃),可进行局部冷冻麻醉的应急处理。

完成下列问题:
(1)制取氯乙烷(CH3CH2Cl)的最好的方法是_______________(填序号)。
A.乙烷与氯气反应 B.乙烯与氯气反应
C.乙烷与氯化氢反应 D.乙烯与氯化氢反应
(2)写出所选反应的化学方程式:_______________。该反应的反应类型为_______________。
(3)氯乙烷能用于冷冻麻醉应急处理的理由是______________________________。
【答案】 D CH2=CH2+HCl![]() CH3CH2Cl 加成反应 氯乙烷沸点低,挥发时吸收热量,可起到冷冻麻醉的作用
CH3CH2Cl 加成反应 氯乙烷沸点低,挥发时吸收热量,可起到冷冻麻醉的作用
【解析】(1)A、乙烷与氯气发生取代反应:CH3CH3+Cl2→CH3CH2Cl+HCl,该反应有杂质HCl生成,所以不符合原子经济的理念,A错误;B、乙烯与氯气发生加成反应:CH2=CH2+Cl2→CH2ClCH2Cl,产物是二氯乙烷不是氯乙烷,B错误;C、乙烷与氯化氢很难发生取代反应,C错误;D、乙烯与氯化氢发生加成反应:CH2=CH2+HCl→CH3CH2Cl,生成物只有氯乙烷,符合原子经济理念,D正确,答案选D。(2)乙烯和氯化氢在一定条件下发生加成反应生成氯乙烷,方程式为:CH2=CH2+HCl→CH3CH2Cl;(3)氯乙烷沸点低、易挥发,挥发时吸收热量,使受伤部位皮肤表面温度骤然下降,可起到冷冻麻醉的作用。


科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表得第_____________族,其基态原子中未成对电子的个数为______。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为____________________,所含非金属元素的电负性由大到小的顺序是____________________。
(3)尿素分子中、碳原子为________杂化,分子中σ键与π键的数目之比为____________________。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需要知道的数据是______。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为____________________。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如下图所示,则该物质的化学式为____________________。若晶体密度为dg·cm3,则晶胞中最近的两个碳原子的距离为____________________pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)3.01×1023个CO2分子中含______mol氧原子,在标准状况下其体积为____L,0.4 molOH-的中有______个电子。
(2)某金属氯化物MClx的摩尔质量为133.5g/mol,取该金属氯化物26.7g配成水溶液,与足量AgNO3溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量为________。
(3)同温同压下,等质量的N2和CO2所含分子数比为_____,体积比为________。
(4)某气体在标准状况下的密度为1.25g/L,则28g该气体所含有的分子数为________。
(5)用98%的浓硫酸(ρ=1.84 g/cm3)配制1 mol/L的稀硫酸l00mL,配制过程中需量取浓硫酸____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)甲基的电子式_________________。
(2)写出4-甲基-2-乙基-1-戊烯的键线式___________________________。
(3)有机物![]() 系统名称是_______________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是___________________。
系统名称是_______________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是___________________。
(4)①等物质的量的A.甲醇、B.乙醇、C.乙二醇、D.丙三醇,分别和足量的金属钠作用,放出氢气的量由少到多的顺序是_______________;
②等质量的A.甲醇、B.乙醇、C.乙二醇、D.丙三醇,分别和足量的金属钠作用,放出氢气的量由少到多的顺序是_______________。
提示:甲醇:CH3OH、乙二醇:![]() 、丙三醇:
、丙三醇:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列如图所示是实验中常见的几种仪器:
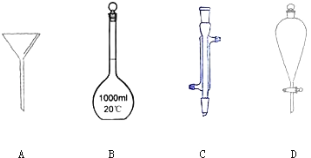
写出各字母代号所代表的仪器的名称 A : _____, B : _____, C : _____,D :__。
Ⅱ. 实验 室要配制 500 mL 0.2 mo l/ L NaOH 溶液 ,请 回 答 下列 问题:
(1)用托盘天平称取氢氧化钠,其质量为 _____g .
(2) 下列 主要操作步骤的正确顺序是 _____(填序号).
① 称取一定质量的氢氧化钠,放入烧杯 中 ,用适量蒸馏水溶解;
② 加水至液面离容量瓶颈刻度线下 1 -2 厘 米 时 , 改 用 胶 头 滴 管 滴 加 蒸 馏 水 至 凹 液 面 与 刻度线相切;
③ 待冷却至室温后,将溶液转移到 5 0 0 mL 容 量 瓶 中 ;
④ 盖好瓶塞,反复上下颠倒,摇匀;
⑤ 用少量的蒸馏水洗涤烧杯内壁和玻璃棒 2 ~ 3 次,洗涤液转移到容量瓶 中轻摇容量 瓶,使混合均匀 .
(3) 实验误差分析
① 如果 实验 过程 中 缺少步骤 ⑤ ,会使配制出的 N a O H 溶液浓度 _____(填 “偏高 ”或“偏低 ”或 “不变 ”,下同 )
②最终定容时 俯 视观察液面 会使配制出的 NaOH 溶液浓度 _____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是

A. 曲线a表示Fe(OH)2饱和溶液中的变化关系
B. 除去CuSO4溶液中含有的少量Fe2+,可加入适CuO
C. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6 :1
D. 向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)在装置A和装置B中都用到玻璃棒,装置B中玻璃棒的作用是__________,防止蒸发皿内溶液因局部过热而溅出。
(2)装置C中①的名称是__________,冷却水的方向是__________。装置D在分液时为使液体顺利滴下,应进行的具体操作是__________.
(3)除去自来水中的Cl-等杂质,选择装置__________(填代表装置图的字母,下同)。检验自来水中Cl-是否除净的方法:取少量锥形瓶中的水于洁净试管中,滴加__________,不产生白色沉淀表明Cl-已除净。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法错误的是()
A. 常温常压下,4gD2O中含有的电子数为2NA
B. 42gC2H4和C4H8的混合气中含有氢原子数为6NA
C. 25℃时,pH=1的H3PO4溶液中含有H+数为0.1NA
D. H2O(g)通过Na2O2(s)使其增重bg时,反应中转移的电子数为bNA/2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com