
| A. | 未冷却就转移、定容 | B. | 未洗涤烧杯及玻璃棒 | ||
| C. | 定容时俯视刻度线观察液面 | D. | 容量瓶原有少量蒸馏水 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 | B. | N2 | C. | H2 | D. | O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)?2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.
在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)?2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
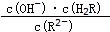 将减小(填“增大”或“减小”或“不变”或“无法判断”)
将减小(填“增大”或“减小”或“不变”或“无法判断”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水吸收少量SO2气体:NH3•H2O+SO2→NH4++HSO3- | |
| B. | FeI2溶液中通入Cl2至Fe2+恰好完全被氧化:2Fe2++Cl2→2Fe3++2Cl- | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-→CO32-+H2O | |
| D. | 在Ca(ClO)2溶液中通入足量的CO2气体:ClO-+CO2+H2O→HClO+HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com